Kako poslovica kaže, potrebno je selo da bi se podiglo dete. Takođe može biti potrebno selo da napreduje u nauci i medicini.
U ovom slučaju, laboratorije iz ne jednog, ne dva, već tri odeljenja Instituta Blavatnik na Harvardskoj medicinskoj školi, zajedno sa kolegom iz Francuske, okupile su se da otkriju strukturu lukavog receptora uključenog u srce, pluća, jetru, i funkciju bubrega kao i trudnoću.
Raspetljavanje ove strukture, opisano 20. aprila u Nature Chemical Biologi, pruža osnovu za razvoj lekova koji deluju na receptore sa ciljem lečenja srčanih bolesti i stanja obeleženih nagomilavanjem ožiljnog tkiva ili fibroze. To uključuje idiopatsku plućnu fibrozu, hroničnu bolest pluća; nealkoholna masna bolest jetre; i skleroderma, koja pogađa kožu, zglobove i unutrašnje organe.
Rad takođe može izazvati interesovanje drugih naučnika koji proučavaju osnovnu biologiju jer receptor ima neobičnu strukturu koja se izdvaja od ostalih članova njegove porodice, receptora spojenih sa G proteinom.
„Ovo je bio veoma težak receptor za karakterizaciju“, rekao je stariji autor Andrev Kruse, profesor biološke hemije i molekularne farmakologije HMS-a. „Saradnja više laboratorija je bila od suštinskog značaja, a projekat naglašava vrednost kombinovanja eksperimentalnih i računarskih metoda.“
„U HMS-u imate mnogo sjajnih mogućnosti da radite sa talentovanim naučnicima koji koriste različite tehnike od vas“, složila se Sara Erlandson, koja je kao diplomirani student vodila rad u laboratoriji Kruse. „To nam je omogućilo da formiramo potpuniju sliku receptora i proučavamo ga na više načina nego što bismo mogli sami.“
Ime receptora je puna usta: peptidni receptor 1 porodice relaksina/insulina, ili RKSFP1. To ime dobija jer se on i njegova tri brata i sestre receptora vezuju za hormone zvane relaksin.
Relaksini su najpoznatiji po pokretanju niza promena u telu tokom trudnoće, uključujući opuštanje ligamenata u karlici u pripremi za porođaj. Takođe podstiče kretanje spermatozoida. Ali naučnici su takođe cenili mnoge nereproduktivne uloge ovog hormona, uključujući širenje krvnih sudova kako bi se povećao protok krvi, stimulisanje rasta novih krvnih sudova, razbijanje kolagena i smanjenje upale i fibroze.
Relaksini rade sve ovo kada se oslobode iz tkiva kao što su srce, prostata i placenta i vežu se za receptore u membranama ćelija u određenim organima. Receptori zatim šalju signale koji podstiču ćelije da deluju.
Većina relaksina ostaje lokalno, ali jedan tip, relaksin-2, putuje kroz telo kroz krv. Ovo je relaksin koji se vezuje za RKSFP1.
Učešće relaksin-2 u toliko telesnih procesa usmerilo je oči naučnika ka lečenju bolesti oponašanjem viših ili nižih nivoa hormona. Za to je potrebno dizajnirati lekove koji se vezuju za RKSFP1 – što je teško uraditi bez poznavanja njegove strukture.
„Nema dostupnih lekova koji ciljaju na ovaj receptor“, rekao je Erlandson, koji sada radi kao istraživač u Takeda Pharmaceuticals. „Ljudi su zainteresovani za to kao opciju za lečenje kardiovaskularnih i fibroznih bolesti, ali kada ne razumete detaljnu strukturu, to ograničava vašu sposobnost da je ciljate.“
Dakle, ekipe su prionule na posao.
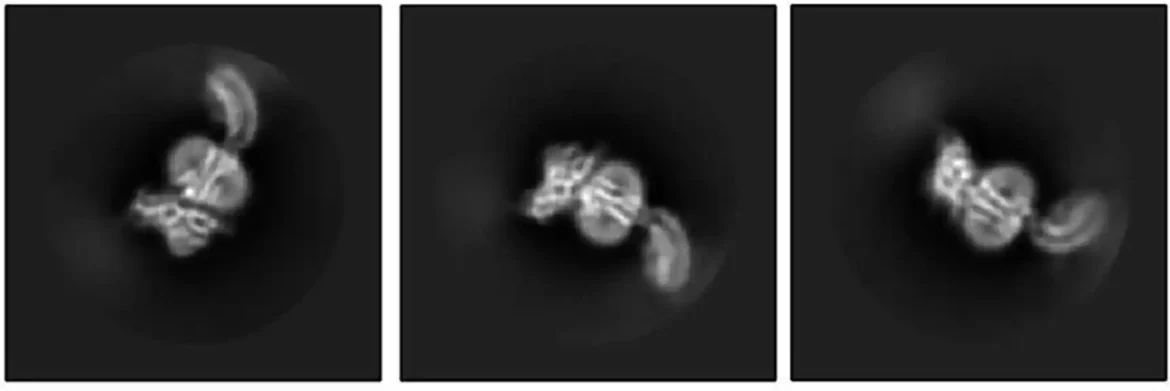
Laboratorija Kruse je napravila prvi korak koristeći krio-elektronsku mikroskopiju kako bi otkrila kako RKSFP1 izgleda na skoro atomskom nivou kada je vezan za relaksin-2.
Ali jedno zamućeno mesto je ostalo na mestu gde je fleksibilni deo receptora stalno menjao položaj sa jednog snimka na drugi. Taj neuhvatljivi deo je bio najvažniji – deo koji se vezuje za relaksin.
Članovi laboratorije Stevena Gigija, profesora ćelijske biologije HMS-a, pozabavili su se problemom koristeći masenu spektrometriju, drugačiji metod za određivanje strukturnih informacija koje mere atomske težine. Kombinovanje eksperimentalnih rezultata krio-EM sa podacima masene spektrometrije omogućilo je Erlandsonu da popuni nedostajuće strukturne detalje.
Sada su istraživači mogli da vide receptor u njegovom aktivnom, ili „uključenom“, stanju, vezan za relaksin-2. Struktura je sugerisala da bi se receptor mogao sam uključiti. Ako je to tačno, šta ga je sprečilo da bude stalno uključen, šaljući signale za aktivaciju ćelija da li je relaksin bio tu ili ne?
Uvid je došao od Debora Marks, vanredne profesorke sistemske biologije u HMS-u i Sjaojing Konga sa Instituta za funkcionalnu genomiku (IGF) u Francuskoj. Koristili su računarske tehnike – uključujući i onu koja se zove evoluciona analiza spajanja, koja posmatra sekvence proteina koje se zajedno menjaju tokom vremena – da predvide kako bi se različiti delovi receptora mogli menjati između aktivnih i neaktivnih stanja.
Najzad se priča otkrila.
Kada je RKSFP1 sam, nema opuštanja na vidiku, isključen je. Kada se relaksin-2 veže za njega, više delova receptora menjaju oblik i komuniciraju jedan sa drugim da bi uključili prekidač.
Saradnja je omogućila timu da odgovori na otvorena pitanja o tome kako se višestruki delovi RKSFP1 kreću i rade zajedno kako bi omogućili receptoru da radi svoj posao. Način na koji se vezuje za relaksin-2 nije viđen kod mnogih njegovih srodnika receptora.
Sa aktivnom strukturom RKSFP1 u ruci, istraživači sada imaju bravu za dizajniranje terapeutskih ključeva.
„Bilo je zaista uzbudljivo doći do tačke u projektu gde smo videli strukturu i došli do ovih otkrića“, rekao je Erlandson. „Postoji još posla koji treba da se uradi, ali ovo daje veliki doprinos koji koristi naučnicima i na kraju može pomoći pacijentima.“
Dodatni autori su Shaun Ravson, James Osei-Ovusu, Kelli P. Brock, Ksiniue Liu, Joao A. Paulo i Julian Mintseris, iz HMS-a.