Alchajmerova bolest (AD) ostaje jedan od najizazovnijih i najrasprostranjenijih neurodegenerativnih poremećaja, koji pogađa milione širom sveta. U dve nedavne studije, istraživači predvođeni prof. Lusijom Čavez Gutijerez (VIB-KU Leuven), prof. Vilijamom Moblijem (UCSD, SAD) i prof. Karstenom Hopfom (CeMOS, Manhajm, Nemačka) rasvetlili su ulogu toksičnog proteina fragmenata i sastava plaka u AD, nudeći dragocene uvide za buduća istraživanja i potencijalne tretmane.
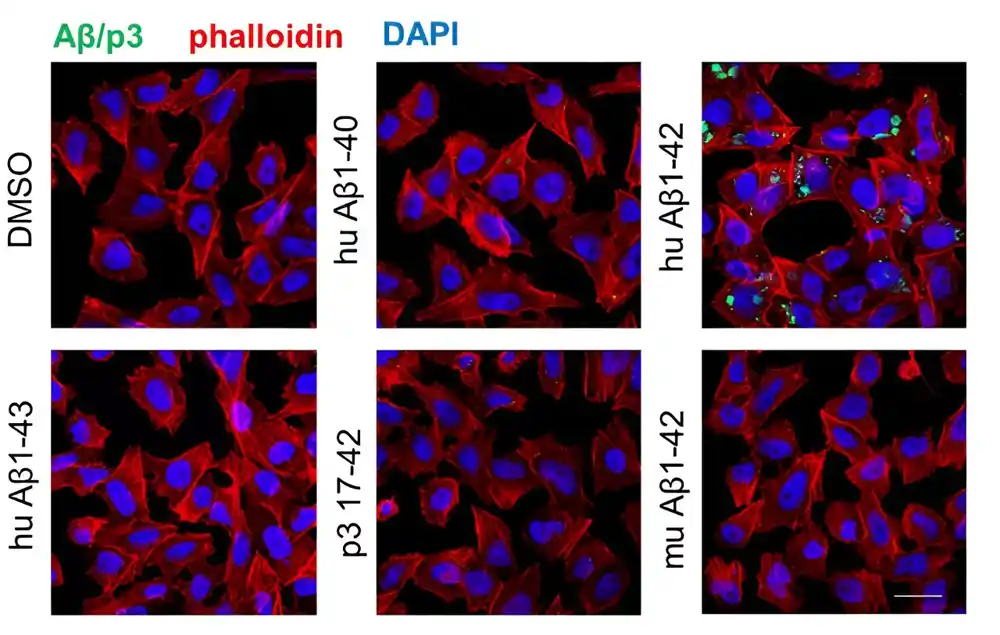
Jedna od ključnih vidljivih karakteristika u mozgu osoba sa Alchajmerovom bolešću (AD) je prisustvo amiloidnih plakova. Ovi plakovi se formiraju u neuronima i sastoje se od nakupina pogrešno savijenih fragmenata β-amiloida (Aβ). Ovi fragmenti su produkti razgradnje amiloidnog prekursora proteina (APP), koji se nalazi u ćelijskim membranama moždanih ćelija.
Mozak neprestano proizvodi nove APP molekule dok razgrađuje i uklanja stare. Ovaj proces ‘odlaganja otpada’ uključuje enzimsko cepanje, sa gama-sekretazom kao enzimom koji proizvodi dobro poznate toksične Aβ peptide u AD.
Laboratorija prof. Lusije Čavez Gutijerez u VIB-KU Leuven centru za istraživanje mozga i bolesti fokusirana je na razumevanje uloge cepanja proteina u molekularnim mehanizmima koji leže u osnovi AD. Dve nove studije njenog tima sada pružaju značajan korak napred u razumevanju uloge inhibicije gama-sekretaze i važnosti sastava amiloidnog plaka.
Prva studija, objavljena u eLife, otkriva novi način na koji Aβ42, Aβ -fragmenti dužine 42 građevna bloka (aminokiseline), doprinose neuronskoj fiziologiji i potencijalno neurodegeneraciji. Studija otkriva da Aβ42 može ometati funkciju gama-sekretaze, koja je neophodna za ćelije.
„Pored razgradnje APP, gama-sekretaza je takođe ključna za normalnu ćelijsku signalizaciju“, objašnjava dr Katažina Žoltovska, prva autorka studije.
„Otkrili smo da se Aβ42 vezuje i inhibira gama-sekretazu, što dovodi do nagomilavanja drugih toksičnih ćelijskih materijala koji na kraju mogu izazvati smrt neurona. Naši nalazi sugerišu da Aβ42 može pogoršati Alchajmerovu bolest ne samo akumulacijom u plakovima već i direktno mešanje u ćelijske procese.“
Dr Utpal Das (UCSD, SAD), koji je takođe doprineo studiji, dodao je: „Istraživači sada mogu da istraže načine da spreče Aβ42 da inhibira gama-sekretazu, čime se potencijalno obnavlja normalna ćelijska komunikacija.
Druga studija, saradnja između VIB-KU Leuvena i Centra za masenu spektrometriju i optičku spektroskopiju (CeMOS) na Univerzitetu primenjenih nauka u Manhajmu i objavljena u Analitičkoj hemiji, bavi se pitanjem heterogenosti plaka.
Tradicionalno, amiloidni plakovi se posmatraju kao jednoobrazni entiteti. Međutim, moćna nova tehnika nazvana multimodalna masovna spektrometrija u kombinaciji sa mašinskim učenjem i koja je radila u Hopf laboratoriji otkrila je iznenađujući nivo raznolikosti među ovim plakovima.
„Naše istraživanje u potpunosti redefiniše naše razumevanje amiloidnih plakova“, kaže dr Tomas Enclajn, prvi autor studije. „Analizom pojedinačnih plakova na nivou jednog molekula, otkrili smo da se njihov sastav prilično razlikuje. Plakovi sadrže različite nivoe Aβ i drugih masnih molekula zvanih lipidi. Štaviše, izgleda da se specifična šminka značajno razlikuje između pacijenata sa punim AD i oni koji imaju amiloidne naslage, ali nemaju kognitivni pad.“
Sposobnost razlikovanja između „štetnih“ i „benignih“ plakova na osnovu njihovog molekularnog otiska prsta ima veliki potencijal za razvoj preciznih dijagnostičkih alata koji mogu razlikovati pojedince u riziku od kognitivnog pada i onih koji možda neće napredovati u AD. Pored toga, otvara put ciljanim terapijama koje se odnose na specifične kompozicije plaka.
Ovi nalazi naglašavaju složenu prirodu AD i potrebu za višestranim pristupom u borbi protiv bolesti.
Profesor Lusija Čaves Gutijerez je rekla: „Potrebno je više istraživanja, ali razumevanjem kako Aβ remeti ćelijske funkcije i varijacije unutar amiloidnih plakova, možemo razviti bolje strategije za borbu protiv ove razorne bolesti.“