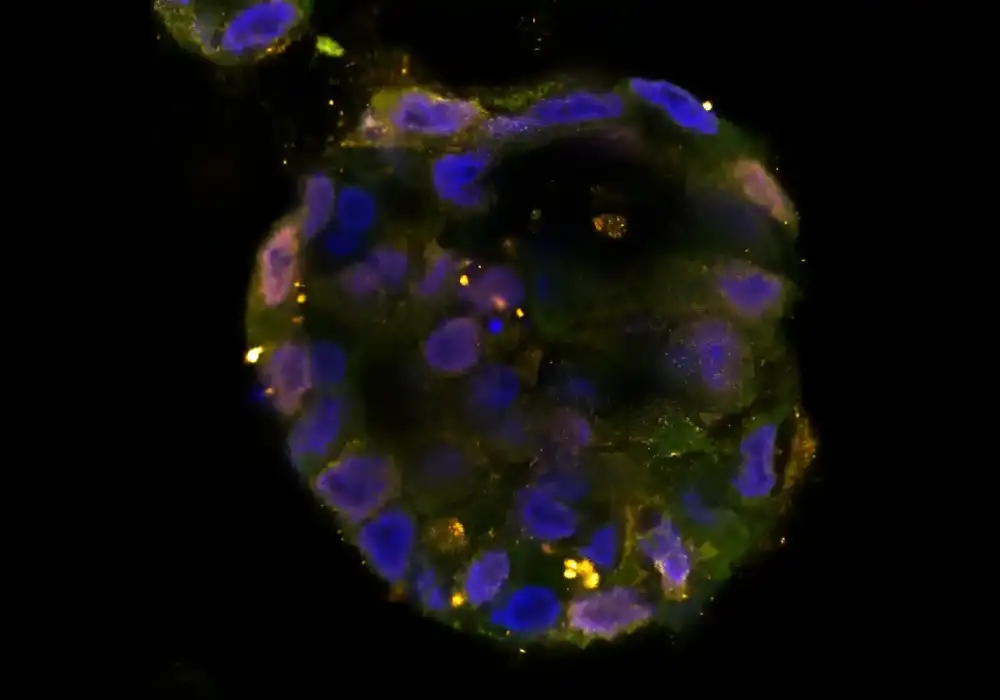
Kako se mogu analizirati molekularne strukture kada rezolucija dostupnih tehnika nije dovoljna? Istraživači iz oblasti fizike, hemije i medicine sa Univerziteta Hajnrih Hajne u Dizeldorfu (HHU) kombinovali su i dalje razvijali različite mikroskopske i spektroskopske tehnike kako bi ispitali raspored proteina u ćelijskoj membrani koji je važan za „programiranu ćelijsku smrt“.
U članku objavljenom u časopisu Science Advances, oni sada opisuju okolnosti pod kojima CD95 receptor — koji je odgovoran za ćelijsku smrt — reaguje.
U biološkim ćelijama, velika većina funkcionalnih struktura se sastoji od proteinskih molekula. Da bi se razumela funkcija proteina, mora se znati njihova trodimenzionalna struktura. Takođe je važno zabeležiti njihov prostorni raspored i dinamičku interakciju između njih i sa drugim proteinima u njihovom neposrednom i širem okruženju, jer ovi faktori često pokreću njihovu funkciju.
Dobijanje ovih informacija je veoma složeno i takva merenja su delimično na granicama onoga što je tehnički moguće. Pošto su relevantne strukture proteina često veličine samo 1 do 100 nanometara (nm; milijardni deo metra), one se ne mogu razrešiti korišćenjem konvencionalnih optičkih mikroskopa.
Napredne tehnike visoke rezolucije kao što je „mikroskopija stimulisanog smanjenja emisije“ (skraćeno: STED mikroskopija), koja je nagrađena Nobelovom nagradom za hemiju 2014, takođe nisu dovoljne same po sebi.
Istraživački tim na čelu sa profesorkom dr Kornelijom Monzel (Institut za eksperimentalnu medicinsku fiziku) i profesorom dr Klausom A. M. Zajdelom (katedra za molekularnu fizičku hemiju) sada je kombinovao različite tehnike kako bi razumeo način rada tzv. CD95. receptor na površini ćelijskih membrana. Cilj je bio da se utvrdi potpuni molekularni raspored i interakcija receptora potrebnih za pokretanje ćelijskog signala.
CD95 receptor je od fundamentalne važnosti za ćelije: signal, koji na kraju dovodi do kontrolisane ili programirane ćelijske smrti — „apoptoze“ — pokreće se preko ovog proteina.
Profesor Monzel, jedan od dva korespondentna autora studije, kaže: „Svakodnevno, ovaj signalni put je odgovoran za činjenicu da ne rastemo stalno osiguravajući da onoliko postojećih ćelija umre koliko novih ćelija. Takođe igra važnu ulogu u mnogim drugim procesima kao što su razvoj živih bića, zarastanje rana i terapija raka.
Ovaj receptor je veličine samo oko 20 nm. Dr Nina Bartels, jedan od dva glavna autora studije, kaže: „Pošto ne možemo direktno i jasno da rešimo ove male strukture koristeći tehnike visoke rezolucije, morali smo dalje da razvijamo različite mikroskopske i spektroskopske tehnike i kombinujemo ih.“
Pored STED mikroskopije, koja može da razreši strukture do 40 nm, istraživači u Diseldorfu su takođe razvili takozvanu Forster rezonantnu spektroskopiju prenosa energije (FRET) i dalje analizu koraka fotobeljenja. Kao rezultat, oni mogu da izmere broj, distribuciju i interakciju receptora na membrani do samo nekoliko nanometara.
Dr Nikolas van der Voort, drugi vodeći autor studije, kaže: „Na osnovu naših merenja, uspeli smo da razvijemo jasan model koji su procesi potrebni za aktiviranje CD95 receptora i na taj način kontrolisana smrt ćelije. Da bismo uključili signala ćelijske smrti, samo 15% svih CD95 receptora na ćelijskoj membrani treba da se veže po dva ili tri oko daljeg proteina, takozvanog CD95 liganda.“
Profesor Zajdel, drugi odgovarajući autor studije, ukazuje na šire aspekte rezultata istraživanja. „Pored nalaza koji se odnose na aktivaciju kontrolisane ćelijske smrti, ovaj rad opisuje važna mikroskopska i spektroskopska dostignuća, koja se mogu preneti na mnoga druga biološka i medicinska pitanja.“