Metastaze raka su glavni uzrok smrti od raka. Istraživački tim na Gradskom univerzitetu u Hong Kongu (CitiU) nedavno je identifikovao protein koji pokreće migraciju ćelija raka jetre i pankreasa i metastaze i povezan je sa skraćivanjem vremena preživljavanja pacijenata.
Nalazi istraživanja su verifikovani in vitro i in vivo modelima, podržani kliničkim podacima, i očekuje se da će pružiti novu potencijalnu metu za terapiju raka. Studija je objavljena u časopisu Molecular Cancer, pod naslovom „Lizil hidroksilaza LH1 promoviše ograničenu migraciju i metastaze ćelija raka stabilizacijom Septina2 radi poboljšanja mreže aktina.
„Metastaze raka su složen proces. Poznato je da se krutost tumora i okolnih tkiva povećava zajedno sa rastom tumora, što stvara ograničene prostore ili kanale nalik na tragove pora za migraciju tumorskih ćelija i metastaze kod više vrsta raka. Ali mehanizam ove ograničene migracije ostaje nejasno“, rekao je profesor Michael Iang Mengsu, potpredsednik (istraživanje i tehnologija) i profesor biomedicinskih nauka Ieung Kin Man u CitiU-u, koji je vodio međuinstitucionalno istraživanje. „Cilj nam je da duboko proučimo mehanizam metastaza raka i identifikujemo nove gene i proteine koji su povezani sa njim.“
Hepatocelularni karcinom (HCC) je najčešći tip drugog vodećih uzroka smrti od raka širom sveta – karcinom jetre. Duktalni adenokarcinom pankreasa (PDAC) je još jedan veoma agresivan rak sa petogodišnjom stopom preživljavanja manjom od 10%. Oba imaju tipičnu karakteristiku solidnih tumora sa prekomernim taloženjem ekstracelularnog matriksa (ECM) koji sadrži ograničene pore ili kanale nalik na tragove koji omogućavaju migraciju ćelija raka. Tako je tim odabrao ova dva različita tipa raka kao subjekte studije.
U saradnji sa Drugom pridruženom bolnicom Medicinskog univerziteta u Čongkingu (CKMU), tim profesora Janga je prvo prikupio HCC i PDAC uzorke za analizu od 153 odnosno 63 pacijenta, koji nisu primali hemoterapiju ili radioterapiju pre operacije. Tim je takođe dobio ćelijske linije raka jetre kod ljudi i raka pankreasa od Nacionalnog instituta za zdravlje u SAD.
„Glavni izazov je bio da se simulira složeno mikrookruženje raka“, objasnio je profesor Jang. „Ali postoji nedostatak modela proučavanja migracije ćelija u ograničenom okruženju. Tako smo razvili niz multidimenzionalnih platformi i 2D i 3D in vitro i in vivo modela da bismo sveobuhvatno proučavali proces migracije ćelija.“
Ove platforme i modeli uključuju mikrofluidne čipove za jednoćelijsku i kolektivnu ćelijsku migraciju i hidrogelove različite krutosti za 3D testove invazije za simulaciju in vivo okruženja. Tim je takođe koristio sekvenciranje sledeće generacije (NGS) i tečnu hromatografiju-masenu spektrometriju (LC-MS) da bi odredio različito eksprimirane gene i proteine u tkivima raka.
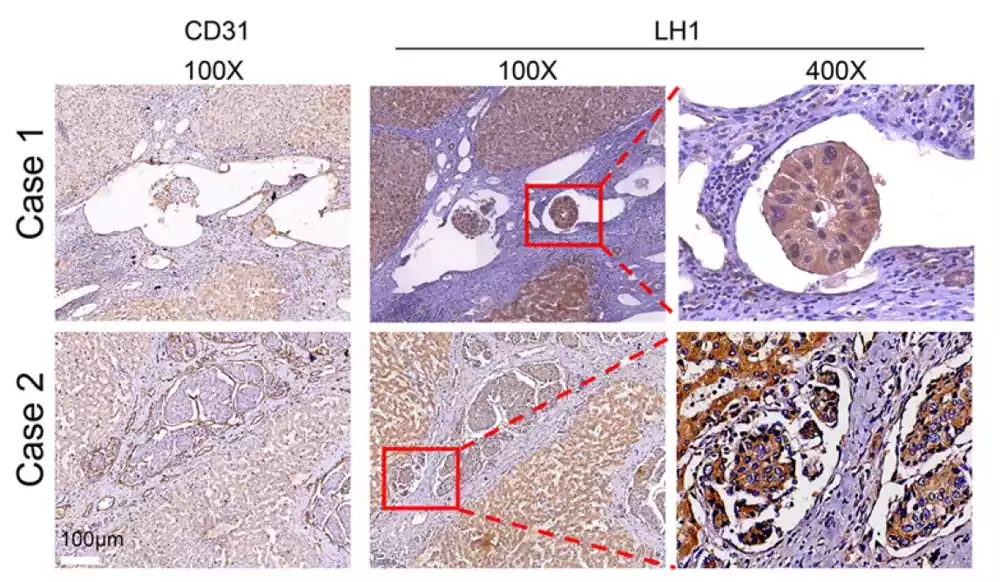
Na osnovu transkriptomske analize sa NGS-om i proteomske analize sa LC-MS, tim je identifikovao protein nazvan lizil hidroksilaza 1 (LH1) kao jedan od proteina sa najvećom ekspresijom u HCC tkivima. Mikrofluidni čipovi i 3D modeli invazije koje su razvili pokazali su sposobnost LH1 da promoviše ograničenu migraciju na višedimenzionalnim nivoima, uključujući brzinu i kapacitet invazije HCC i PDAC ćelija. Efekti se mogu potisnuti obaranjem ekspresije LH1.
Takođe su pokazali da LH1 može da veže i stabilizuje Septin2 (SEPT2), protein koji igra suštinsku ulogu u pripremanju ćelija za visoku mehaničku potrebu za migracijom, kako bi poboljšao formiranje aktinske mreže. Aktinska mreža je najdinamičniji element citoskeleta, raspoređena je po ćelijskoj citoplazmi i kontroliše ćelijsku mehaniku i pokretljivost. Dakle, pojačano formiranje aktinske mreže može promovisati ograničenu migraciju i metastaze HCC i PDAC ćelija.
Istraživački tim je takođe analizirao korelaciju između LH1 i prognoze (tj. razvoja bolesti i šanse za recidiv) pacijenata sa HCC i PDAC. Klinički uzorci su pokazali da pacijenti sa većom ekspresijom LH1, zajedno sa lošom prognozom, imaju samo polovinu stope preživljavanja grupe sa niskom ekspresijom LH1.
Štaviše, pacijenti sa HCC i PDAC sa visokom ekspresijom LH1 imali su kraće ukupno vreme preživljavanja od datuma dijagnoze do smrti od 39, odnosno 17 meseci, u poređenju sa 86 i 22 meseca za pacijente sa nižim nivoom LH1. Takođe, njihovo vreme preživljavanja bez bolesti od primarnog lečenja do relapsa bolesti bilo je 11,5 odnosno 14 meseci, u poređenju sa 41 i 19 meseci za pacijente sa nižim nivoom LH1.
„Platforme i metode koje smo razvili pružaju jedinstven pristup proučavanju ograničene migracije ćelija raka“, rekao je profesor Jang. „Pokazali smo da LH1 promoviše ograničenu migraciju i metastaze ćelija raka stabilizacijom SEPT2, i da je visok LH1 povezan sa lošom prognozom pacijenata sa HCC i PDAC. Očekuje se da će nalazi pružiti potencijalnu novu metu za dijagnozu raka i razvoj lekova.“