U međunarodnoj saradnji, istraživači su napravili važno proboj u terapijskoj isporuci mikronaca protiv Duchenne mišićne distrofije, bolesti bez lečenja, do danas.
Duchenne mišićna distrofija je genetski poremećaj koji karakteriše progresivni gubitak mišićne mase, zbog mutacija u distrophinskom genu. Bez odgovarajućeg funkcionalnog proteina, mišići ne mogu pravilno da funkcionišu ili poprave, što rezultira propadanjem skeletnog, srčanog i pluća mišića. Pošto je distrophin gen smešten na k hromozom, to uglavnom utiče na muškarce, dok su žene obično nosači.
Istraživači su razvili strategiju za lečenje mišićne distrofije, koja koristi nanočestice kao vozila za prevoz terapijskih mikrona u mišićnim matičnim ćelijama. Jednom u ćelijama mišićnih matičnih ćelija, nanočestici otpuštaju mikroRatu da podstakne proizvodnju mišićnih vlakana.
Studija se objavljuje u časopisu Kuelant Communications.
Microrna je klasa molekula RNA koji igraju presudnu ulogu u regulaciji gena. Isporuka mikronaca kroz krvotok je komplikovana, zbog niske stabilnosti i penetracije. U tom kontekstu, nanočestici se ponašaju kao sigurni bioOstrari i poboljšavaju isporuku ove terapije.
U svom radu, istraživači su razvili aptamer, molekul koji selektivno prepoznaje specifične druge molekule, u ovom slučaju, proteini koji su u ćelijama mišića. Kombinovanjem aptamera nanočertikula, uspeli su da oslobode mikrona na mišićne matične ćelije sa velikom preciznošću i reaktiviraju regeneraciju mišića.
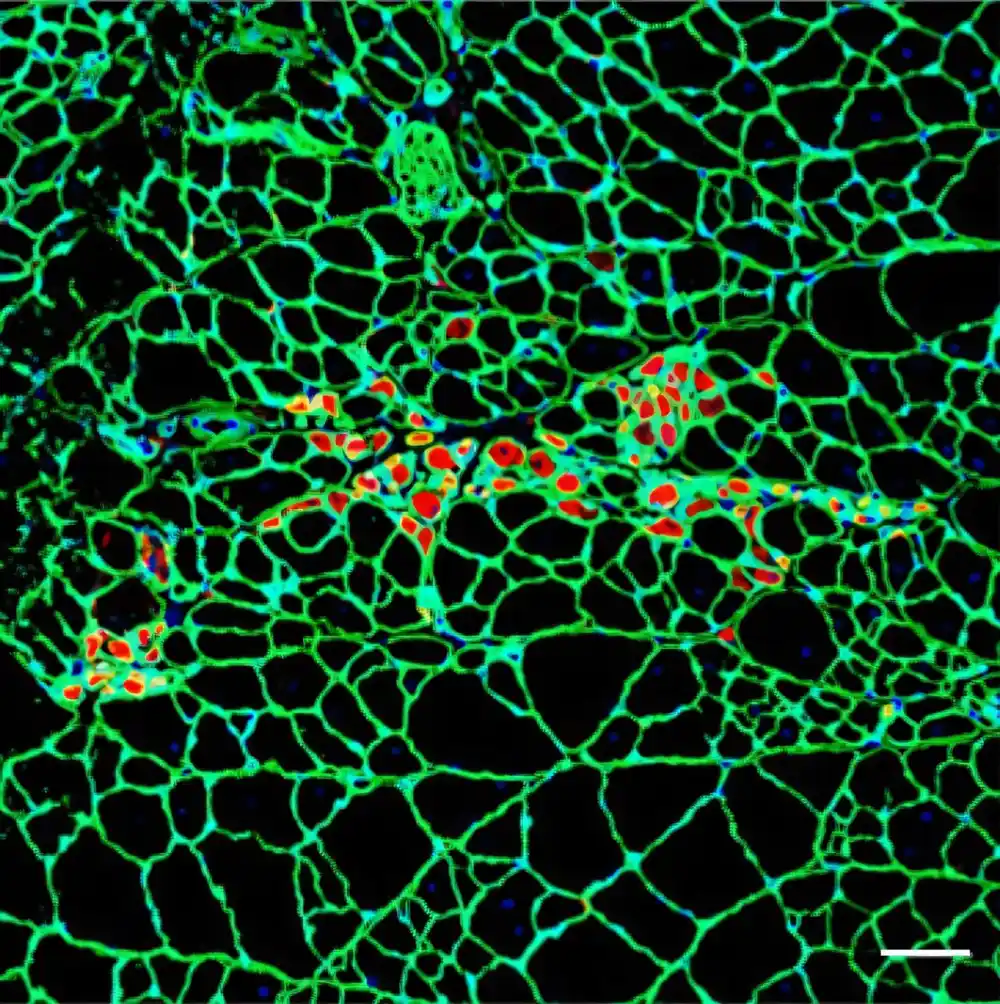
Istraživači su prijavili aktivnost sistema u ćelijskim i životinjskim modelima, gde su primetili ne samo regeneraciju mišića na ćelijskom nivou, već i oporavka na funkcionalnom nivou. Mišići tretiranih miševa poboljšali su se i bili jači nakon tretmana, poboljšavajući funkcionalan kapacitet miševa.
Generalno, kada se nanočertično upravlja intravenski, obično se nakuplja u jetri ili u bubrezima, u zavisnosti od njegove veličine. Pored toga, u ovom procesu, nanostruktura je presvučena proteinima iz plazme – to je takozvani protein corona, koji modulira biorazdeljivost nanočertija. Ovi procesi značajno utiču na to gde se nanočestici akumuliraju, smanjujući efikasnost tretmana.
U ovoj studiji nanovehicles je modifikovano pomenutim aptamerom nakupljaju preferencijalno u mišićima i posebno u ćelijama mišića, gde oslobađaju mikroname koji aktiviraju regeneraciju mišića.
Aptameri su DNK ili RNA pramenovi koji usvajaju specifičnu trodimenzionalnu strukturu, omogućavajući im da se vezuju sa visokim afinitetom na ciljne molekule. Njihov rad je slično onome od antitela, što im omogućava širok potencijal kao biosensore, i u terapiji i dijagnostiku.
Tražite aptamer koji odgovara željenoj terapijskoj meta je poput traženja igle u senu. Da bi to učinio, iterativni proces pod nazivom Selek (sistematska evolucija liganda eksponencijalnim obogaćivanjem) se često koristi, olakšava izbor DNK ili RNA sekvenci sa visokim afinitetom za ciljni molekul. Da bi to učinio, generiše se nasumična biblioteka trilijuna sekvenci nukleinskih kiselina, a zatim se inkubira sa ciljnim molekulom. Verovatno je da neki lanci u biblioteci imaju afinitet prema ciljnom molekulu.
Otkrijte najnovije nauke, tehnike i prostora sa preko 100.000 pretplatnika koji se oslanjaju na Phis.org za svakodnevne uvide.
Prijavite se za naš besplatni bilten i nabavite ažuriranja o proboj,
inovacije i istraživanje koje su važne – svakodnevno ili nedeljno.
Zatim je porodica sekvenci sa visokim afinitetom bira se kroz sledeće pranje i korake pojačanja. Konačno, najefikasniji sekvence se obično optimizuju za stabilnost i funkcionalnost u terapijskim ili dijagnostičkim aplikacijama.
U njihovom nedavnom radu, istraživači su konjugirali nanočestice sa aptamerom protiv Ing Intestra-a, vrlo specifičnog površinskog receptora koji je izrazio mišićne potomke i diferencirane miofiire koje praktično odsutnu u drugim organima ili tkivima. Na ovaj način, bilo je moguće da se nanočestica konjugirala aptamera da efikasno ciljaju mišiće, sa visokom selektivnom ćelijama mišićnih matičnih ćelija.
Alvaro Somoza, olovo autor studije, veoma je oduševljen rezultatima: „Postoje dve vrlo uočljive stvari koje treba istaći. Prvo, efikasna isporuka mikrorine do željenog organa, što povećava efikasnost terapije. Na Druga ruka, ovaj pristup sprečava akumulaciju u drugim organima, poput mozga, bubrega ili jetre, što je ključno za sprečavanje nuspojava. „
Platforma za dostavu za nukleinske kiseline kao što su Micronas, koju je razvio tim prof. Prof. Prof. Somoza, je biokompatibilan, netoksičan i nemunogen i može se lako prilagoditi oslobađanju oligonukleotida različitih vrsta različitih vrsta za lečenje različitih bolesti .
Rad je saradnja istraživača u Imdea Nanociencia (Madrid), koju vodi Alvaro Somoza; Universita Cattolica del Sacro Cuore (Rim), na čelu sa Daniela Palacios; i Univerzitet u Bordou, na čelu sa Jean-Jackues Toulme.