Istraživači sa Medicinske škole Ikan na planini Sinai razvili su inovativni pristup—demonstriran na modelima miša i izolovanom ljudskom moždanom tkivu—kako bi bezbedno i efikasno isporučili terapiju u mozak, pružajući nove mogućnosti za lečenje širokog spektra neuroloških i psihijatrijskih bolesti.
Objavljeno u onlajn izdanju časopisa Nature Biotechnologi od 25. novembra, studija predstavlja prvi svoje vrste konjugat za prelazak krvno-moždane barijere (BCC), dizajniran da prevaziđe zaštitnu barijeru koja obično blokira velike biomolekule da dođu do centralnog nervnog sistema (CNS). Rad je naslovljen „Intravenska primena konjugata koji prelaze krvno-moždanu barijeru olakšava transport biomakromolekula u centralni nervni sistem“.
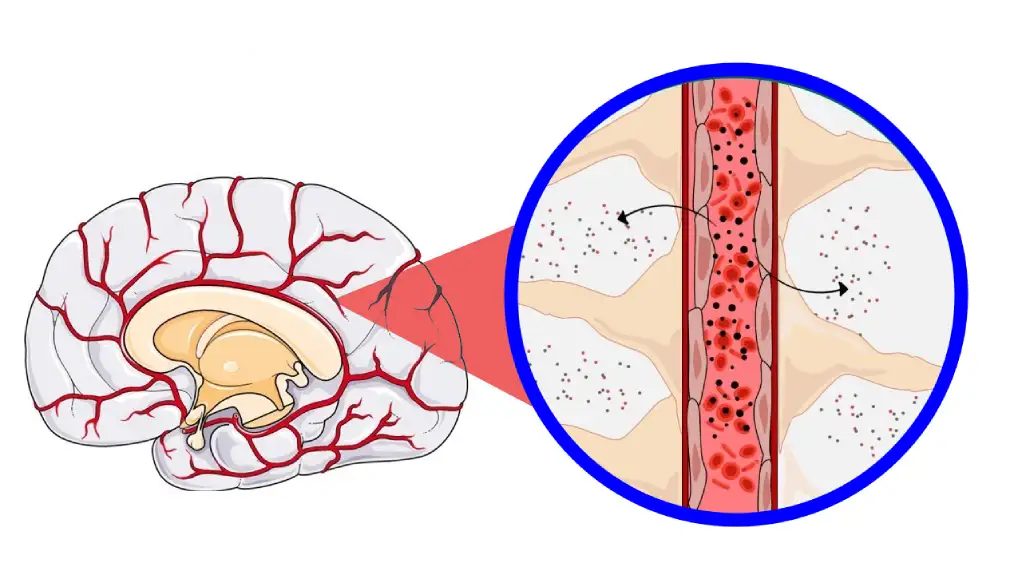
Krvno-moždana barijera je prirodni zaštitni štit koji sprečava štetne supstance da uđu u mozak. Međutim, on takođe blokira isporuku lekova koji spasavaju život, stvarajući značajan izazov u lečenju stanja kao što su amiotrofična lateralna skleroza (ALS), Alchajmerova bolest, zavisnost i mnogi drugi poremećaji CNS-a.
BCC platforma koristi prednosti specijalizovanog biološkog procesa koji se zove transcitoza posredovana γ-sekretazom za isporuku velikih terapeutskih molekula, poput oligonukleotida i proteina, direktno u mozak kroz jednostavnu intravensku injekciju.
„Krvno-moždana barijera je suštinski odbrambeni mehanizam, ali takođe predstavlja značajan izazov za isporuku lekova u mozak“, kaže ko-korespondent stariji autor dr Jidžou Dong, profesor imunologije i imunoterapije i član sa Instituta za genomiku Icahn i Instituta za preciznu imunologiju Marc and Jennifer Lipschultz, na Icahn Mount Sinai.
„Naša BCC platforma razbija ovu barijeru, omogućavajući biomakromolekulima, uključujući oligonukleotide, da bezbedno i efikasno stignu do CNS-a.
Studija je pokazala da kada su istraživači ubrizgali jedinjenje pod nazivom BCC10 povezano sa specijalizovanim genetskim alatima poznatim kao antisens oligonukleotidi u miševe, to je uspešno smanjilo aktivnost štetnih gena u mozgu.
U transgenom mišjem modelu ALS-a (bolest motornih neurona), tretman je značajno snizio nivoe gena koji izaziva bolest zvanog Sod1 i povezanog proteina. Slično tome, drugačiji antisens oligonukleotid povezan sa BCC10 je u velikoj meri smanjio drugi gen, Mapt, koji kodira tau protein i koji je meta za lečenje Alchajmerove bolesti i drugih demencija.
BCC10 se pokazao veoma efikasnim u isporuci ovih genetskih alata u mozak, poboljšavajući njihovu sposobnost da utišaju štetne gene u različitim modelima, pa čak i u uzorcima isečenog ljudskog moždanog tkiva proučavanim u laboratoriji. Važno je da se tretman dobro toleriše kod miševa, uzrokujući malo ili nikakvo oštećenje glavnih organa u testiranim dozama, kažu istraživači.
Uprkos nedavnom napretku u ovoj oblasti, još uvek postoji hitna potreba za tehnologijama koje mogu da zaobiđu krvno-moždanu barijeru i poboljšaju isporuku terapija zasnovanih na biomakromolekulima centralnom nervnom sistemu putem sistemske primene.
„Naša platforma bi potencijalno mogla da reši jednu od najvećih prepreka u istraživanju mozga — da se veliki terapeutski molekuli bezbedno i efikasno prođu kroz krvno-moždanu barijeru“, kaže ko-korespondent stariji autor Eric J. Nestler, MD, Ph.D., Nash Famili Profesor neuronauke, direktor Instituta za mozak Fridman i dekan za akademske poslove Ikan planine Sinaj, i glavni naučni službenik zdravstvenog sistema Mount Sinai.
„Ovaj razvoj ima potencijal da unapredi tretmane za širok spektar moždanih bolesti.“
Zatim, istraživači planiraju da sprovedu dalje studije na velikim životinjskim modelima kako bi potvrdili platformu i razvili njen terapeutski potencijal.