Terapeutici i vakcine zasnovane na RNK-u su nova nada u borbi protiv neizlečivih bolesti. Često korišćena strategija u razvoju medicine RNK (mRNK) zasnovana je na uništavanju mRNK koja izaziva bolest. Postizanje suprotnosti i stabilizacija mRNA koja promoviše zdravlje je i dalje veliki izazov.
Tim Peter ‘t Harta, vođe grupe u Centru za hemijsku genomiku na Institutu za molekularnu fiziologiju Maks Plank, sada je prevazišao ovaj izazov. Hemičari su razvili prvu aktivnu supstancu koja inhibira dedenilaciju iRNK i tako sprečava njenu degradaciju.
Ova studija, koja je sada objavljena u Angevandte Chemie International Edition, nudi obećavajuću polaznu tačku za razvoj inovativnih terapija i alata zasnovanih na mRNA za biologe kako bi pružili dragocen uvid u proces degradacije mRNA.
mRNA prenosi najvrednije ćelijske informacije — hemijski nacrt za proizvodnju proteina — iz jezgra u citoplazmu. Međutim, čim mRNA dostavi svoju poruku fabrikama koje proizvode proteine u citoplazmi, ona više nije potrebna i razgrađuje se egzonukleazama.
U zavisnosti od toga koliko dugo mRNA ostaje u citoplazmi, proizvodi se više ili manje proteina – bilo da promoviše zdravlje ili uzrokuje bolest. Regulacija nivoa mRNK je jedna od najperspektivnijih strategija u novoj oblasti terapije zasnovane na RNK.
Tim je sada razvio novu strategiju za produženje životnog veka mRNK tako što će je zaštititi od njenog rasklapanja. Zanimljivo je da mRNA nije posebno stabilna po prirodi i prerano bi se razgradila bez molekularnih kapica koje štite dva kraja mRNK.
Na svom takozvanom 3’ kraju, mRNA je opremljena poliadeninskim repom prosečne dužine od 200 nukleotida. Ali čak ni ovaj štit ne traje dugo – prosečno vreme poluraspada mRNK je samo sedam sati.
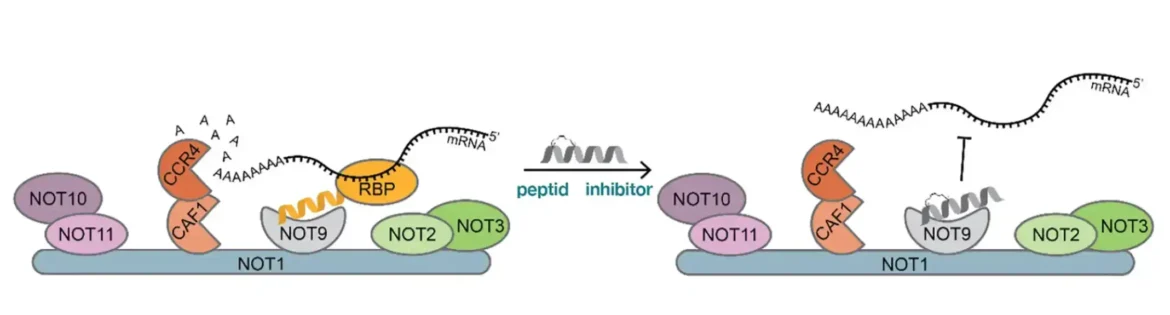
U procesu koji se zove dedenilacija, ciljna mRNA se regrutuje pomoću proteina koji vezuju RNK u proteinski kompleks CCR4-NOT, koji uklanja jedan adenin za drugim. I upravo tu dolazi nova strategija naučnika.
Na osnovu strukture proteina koji vezuje mRNA, razvili su veliki peptid koji može da blokira interakciju CCR4-NOT kompleksa sa ciljnom mRNK. Veliki peptidi, međutim, imaju problema sa prevazilaženjem (prelaskom) ćelijskih barijera, što moraju da urade ako žele da se koriste kao lekovi.
Otkrivanjem 3D-strukture peptidnog inhibitora vezanog za metu, hemičari su bili u stanju da naprave modifikacije koje su poboljšale ćelijsku permeabilnost peptida.
Naučnici su uspeli da odvedu svoj rad još korak dalje i pokažu potencijal svoje strategije u ćelijskim testovima. Tretiranje ćelija peptidom stabilizovalo je poliadeninske repove dva potencijalna proteina koji promovišu zdravlje: tumor supresora, koji bi mogao da ima blagotvorne efekte kod raka i nuklearnog receptora, čiji sve veći nivoi mogu pomoći u lečenju različitih bolesti povezanih sa starenjem.
„Koncept stabilizacije korisnih mRNK blokiranjem njihove mrtvilacije još nije istražen. Pošto skoro sve mRNK prolaze kroz ovaj proces, njihovo blokiranje se može koristiti za razvoj novih lekova koji nude novi način lečenja bolesti gde druge strategije nisu uspele“, kaže ne Hart.
Njegova grupa trenutno radi na razvoju daljih inhibitora protiv drugih komponenti mašinerije za dedenilaciju.