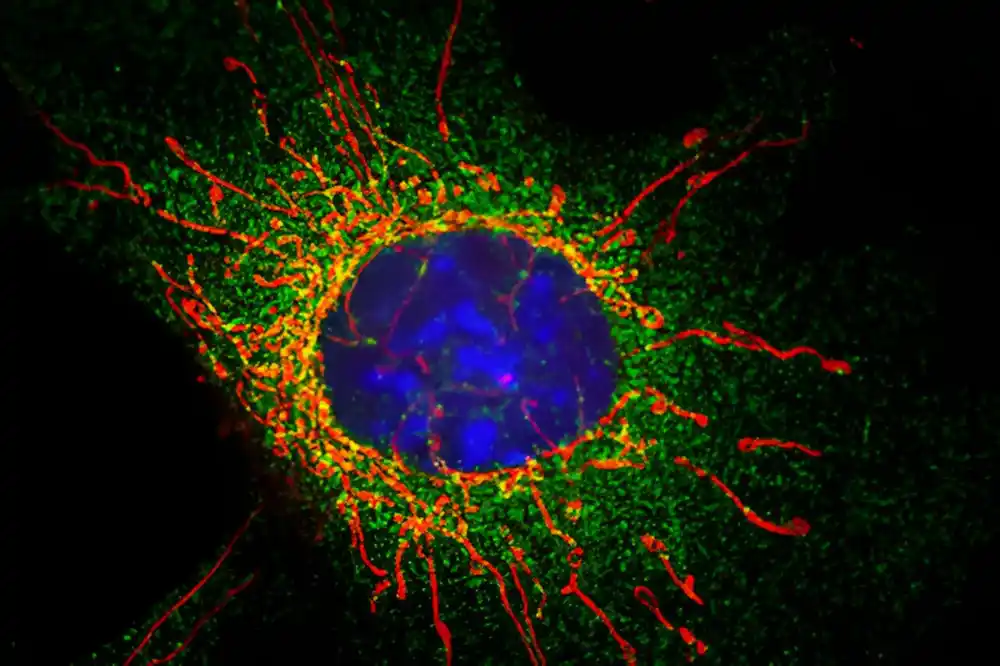
Ključni molekularni korak potreban za podelu oštećenih mitohondrija – neophodan za zdravlje ćelija – identifikovan je u studiji koju je vodio Univerzitet u Bristolu. Ovo otkriće ima potencijal da utvrdi kako mitohondrijska disfunkcija ide po zlu kod uobičajenih neurodegenerativnih bolesti, kao što su Parkinsonova i Alchajmerova bolest.
Istraživanje je objavljeno u časopisu Science Advances.
Glavna funkcija mitohondrija je stvaranje energije neophodne za napajanje ćelija. Prisutne u skoro svim tipovima ljudskih ćelija, mitohondrije su vitalne za ljudski opstanak. Mitohondrije su takođe uključene u druge zadatke, kao što su signalizacija, regulacija ćelijskog metabolizma i ćelijska smrt.
Faktor mitohondrijske fisije (MFF) radi tako što regrutuje sekundarni protein (DRP1) u mitohondrije kako bi podstakao podelu. Međutim, molekularni detalji o tome kako se to dešava nisu u potpunosti shvaćeni.
Istraživački tim je identifikovao ključni protein u deobi mitohondrija, faktor fisije mitohondrija (MFF), kao metu specifične vrste modifikacije za koju je laboratorija specijalizovana nazvan mali modifikator sličan ubikvitinu (SUMO).
Kombinovanjem nalaza iz prethodnih studija, istraživači su pokazali da MFF, kada je modifikovan od strane SUMO-a, ne deluje sam da promoviše podelu, već postoji sa inhibitornim proteinima koji se vezuju zajedno. Kada su mitohondrije oštećene, SUMO modifikuje MFF, koji uklanja ove inhibitorne proteine, a MFF se zatim može vezati za DRP1 kako bi pomogao podelu.
Kada se MFF ne može SUMO modifikovati, mitohondrije se ne dele kada su oštećene. Ovo je ključni nalaz i daje istraživačkom timu bolje razumevanje nijansiranih pravila podele mitohondrija kada su mitohondrije oštećene.
Dr Richard Seager, istraživač-saradnik na Školi za biohemiju na Univerzitetu u Bristolu, i prvi autor rada, rekao je: „Kada smo shvatili prethodni model kako se odjel za podršku MFF-a i DRP1 nije u potpunosti složio sa našim nalazima, mi smo istraživali mehanizam na drugačiji način, posmatrajući druge proteinske igrače.
„Ovo je otkrilo složeniji put koji je spojio nekoliko prethodnih modela kako podela mitohondrija funkcioniše u jedan model, što je veoma uzbudljivo otkriće.“
Džeremi Henli, profesor molekularne neuronauke na Biohemijskoj školi i odgovarajući autor, dodao je: „Mitohondrijska dinamika i ispravna regulacija fuzije i deobe su kritični za zdravlje ćelija. Ovo je naglašeno činjenicom da su brojne ljudske neurodegenerativne bolesti rezultat poremećaja u dinamici mitohondrija usled mutacija u proteinima koji vrše fuziju i podelu.
„Češće neurodegenerativne bolesti, kao što su Parkinsonova i Alchajmerova bolest, pokazuju mitohondrijalnu disfunkciju, a često i više fragmentovane mitohondrije. Razumevanje molekularnih detalja mitohondrijalne podele pružiće istraživačima potencijal da utvrde kako bi ovo moglo poći po zlu i pomoći u eventualnoj prevenciji i lečenju bolesti .“
Istraživanje je uglavnom koristilo ne-neuronske ćelije, kao što su besmrtni fibroblasti, koji su otkrili molekularne detalje modifikacije MFF-SUMO. Mitohondrijska disfunkcija je obeležje neurodegenerativnih bolesti.
Sledeći korak za istraživački tim je da istražuje MFF-SUMO u neuronskom kontekstu, i ispita efekte na morfologiju i funkciju mitohondrija u neuronima, kao i posledice na ponašanje neurona, kao što su veze između neurona, koji su veoma energetski zahtevni. strukture i u velikoj meri se oslanjaju na zdrave mitohondrije.