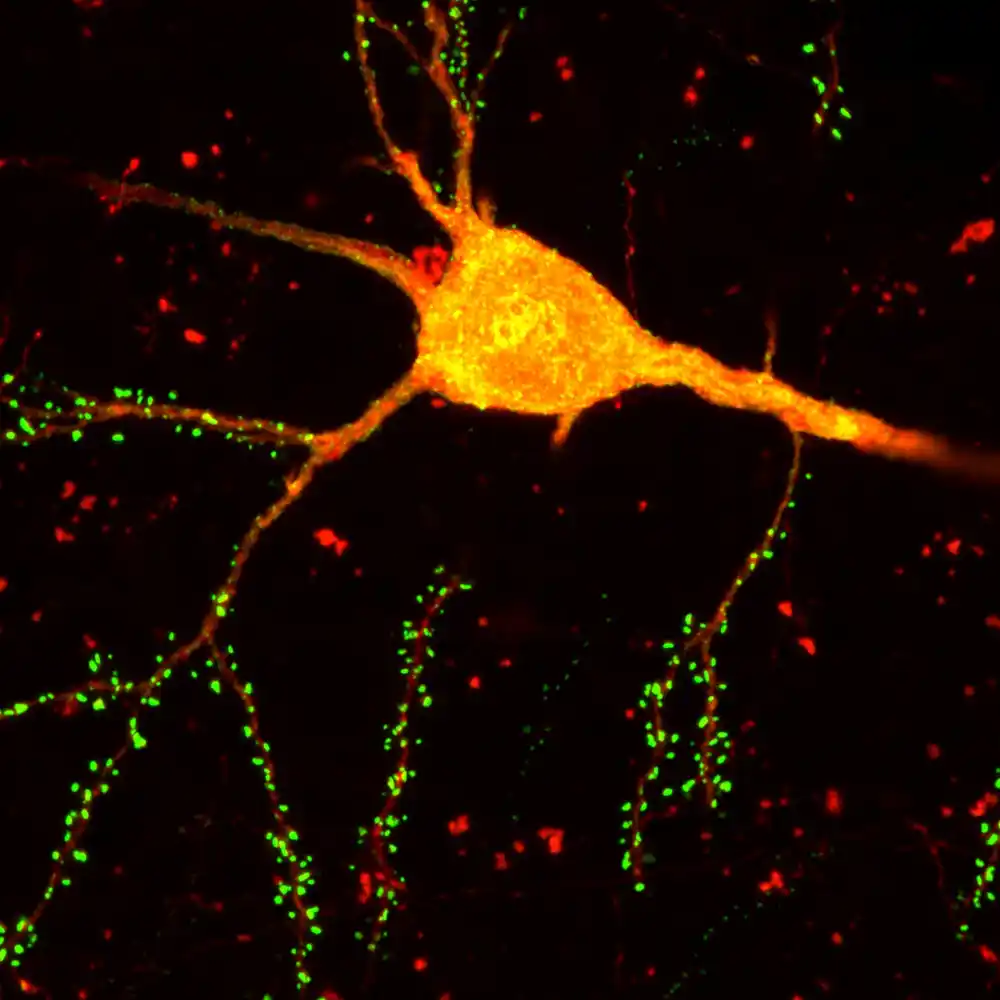
Naučnici sa Instituta Salk otkrivaju novu neurotehnologiju mapiranja mozga pod nazivom Praćenje besnila uz pomoć jednog transkriptoma (START). Najsavremenija alatka kombinuje dve napredne tehnologije — praćenje monosinaptičkog virusa besnila i transkriptomiju jedne ćelije — da bi mapirao složene neuronske veze mozga sa neuporedivom preciznošću.
Koristeći ovu tehniku, istraživači su postali prvi koji su identifikovali obrasce povezivanja koje stvaraju transkriptomski podtipovi inhibitornih neurona u moždanoj kori. Kažu da će ova sposobnost mapiranja povezanosti neuronskih podtipova pokrenuti razvoj novih terapeutika koji mogu ciljati određene neurone i kola sa većom specifičnošću. Takvi tretmani mogu biti efikasniji i proizvesti manje neželjenih efekata od trenutnih farmakoloških pristupa.
Studija, objavljena u Neuronu, prva je koja je rešila kortikalnu povezanost pri rezoluciji tipova transkriptomskih ćelija.
„Kada je u pitanju lečenje neuroloških i neuropsihijatrijskih poremećaja, mi u suštini pokušavamo da popravimo mašinu bez potpunog razumevanja njenih delova“, kaže stariji autor Edvard Kalavej, profesor i Vincent J. Coates Katedra za molekularnu neurobiologiju u Salku. „START nam pomaže da napravimo detaljan nacrt mnogih delova mozga i načina na koji se svi oni povezuju.“
To je kao da pokušavate da popravite automobil, a da ne znate šta je motor ili osovina, kaže on. Ali ako biste imali dijagram delova automobila, mogli biste početi da shvatate kako oni mogu da rade zajedno da bi se točkovi okretali i automobil pomerio. To znanje bi onda znatno olakšalo uočavanje problema u sistemu i odgonetanje koji će vam alati biti potrebni da ga popravite.
Kada se opisuju delovi mozga, neuroni su inicijalno grupisani u dve široke klase: ekscitatorni (oni koji stimulišu moždanu aktivnost) i inhibitorni (oni koji potiskuju aktivnost) – slično gasu i kočnici u automobilu. Odatle se mogu dalje sortirati u podklase: Ekscitatorni neuroni su kategorisani prema sloju mozga u kojem se nalaze, dok se inhibitorni neuroni identifikuju prema proteinima markera koje eksprimiraju.
Nedavni napredak u transkriptomiji sada omogućava da se ove podklase još više razbiju. Koristeći jednoćelijsko RNK sekvenciranje, naučnici sada mogu grupisati ćelije sa sličnim obrascima ekspresije gena i definisati svaki klaster kao specifičan neuronski podtip.
„Definisanje tipa ćelije je komplikovano jer možete da grupišete ćelije drugačije u zavisnosti od toga koji metod koristite da ih pogledate“, kaže Callavai. „Dve ćelije mogu imati malo različite obrasce ekspresije gena, ali obavljaju sličnu funkciju, ili dve ćelije sa sličnom ekspresijom gena mogu biti dalje razdvojene na osnovu njihove anatomije, povezanosti ili fiziologije. Ako uzmete u obzir samo jednu od tih karakteristika, mogli biste završiti Preterano ili nedovoljno podela grupa START nam pomaže da razumemo koji nivo kategorizacije može biti najznačajniji za funkciju kola, i to će obavestiti koje ćelije da ciljamo sa novim terapeuticima.
Da bi kreirala START, Callavai laboratorija je konstruisala način da kombinuje jednoćelijsko sekvenciranje RNK sa drugom tehnikom koju su prethodno razvili: praćenjem monosinaptičkog virusa besnila. Pristup dozvoljava modifikovanom virusu da skače sa jednog tipa ćelije od interesa do samo ćelija koje su direktno povezane sa njim. Otkrivajući gde virus završava, istraživači mogu mapirati koje ćelije su povezane sa kojim.
Istraživači su prvo koristili svoj novi alat za istraživanje obrazaca povezivanja u vizuelnom korteksu miša. START je bio u stanju da razreši oko 50 različitih podtipova inhibitornih neurona u ovom regionu i mapira njihove veze sa ekscitatornim neuronima u svakom sloju korteksa. Nalazi istraživača su identifikovali različite obrasce povezivanja u različitim transkriptomskim podtipovima inhibitornih neurona koji se nisu mogli razlikovati korišćenjem prethodnih metoda.
„Ljudi često tretiraju sve inhibitorne neurone kao jednu jedinstvenu grupu, ali oni su zapravo veoma raznoliki i pokušaji da ih prouče ili klinički ciljaju kao jedna grupa mogu prikriti važne razlike koje su kritične za funkciju mozga i bolest“, kaže prvi autor Maribel Patino, bivši diplomirani student u Callavejevoj laboratoriji i sadašnji specijalizant na psihijatriji na Medicinskom fakultetu UC San Diego.
START je otkrio da je svaki kortikalni sloj ekscitatornih neurona dobio selektivni ulaz od specifičnih transkriptomskih podtipova Sst, Pvalb, Vip i Lamp5 inhibitornih ćelija. Jedinstvena povezanost svakog podtipa pomaže u uspostavljanju sofisticiranih mikrokola koja verovatno doprinose specijalizovanim funkcijama mozga.
Na primer, istraživači su uspeli da reše inhibitorni podtip koji se zove Sst Chodl ćelije, za koje se smatra da su povezane sa regulacijom sna. Koristeći START, otkrili su da su Čodlove ćelije bile tip ćelije koji je najgušće povezan sa ekscitatornim neuronima sloja 6, za koje je poznato da projektuju u talamus da bi koordinirali ritmove spavanja.
Ova rezolucija bez presedana omogućiće neuronaučnicima da nastave da otkrivaju kako specifični neuronski podtipovi oblikuju kola mozga da proizvode naše misli, percepcije, emocije i ponašanja.
Sledeći koraci istraživača su stvaranje virusnih vektora i tehnologija za uređivanje gena koje ciljaju svaki pojedinačni podtip ćelije. U budućnosti, ovi alati bi se mogli prilagoditi u nove terapeutike koji selektivno modifikuju specifične populacije neurona koji doprinose stanjima kao što su autizam, Retov sindrom i šizofrenija.
„Ne znamo tačno kako će se ove informacije koristiti za 10 ili 20 godina od sada, ali ono što znamo je da se tehnologije brzo menjaju i način na koji se mozak danas leči lekovima nije način na koji se mozak danas leči lekovima. će se tretirati u budućnosti“, kaže Callavai. „START može pomoći u pokretanju ove inovacije, tako da su virusi i resursi svi besplatno dostupni za upotrebu čitave neuronaučne zajednice.“