Miofibroblasti stvaraju fibrozne ožiljke nakon povrede kičmene moždine (SCI). Ovo se obično smatra preprekom za regeneraciju nerava. Razumevanje heterogenih karakteristika fibroznih ožiljaka može pomoći da se razviju strategije za remodeliranje fibroznih ožiljaka nakon SCI. Međutim, sastav, poreklo i funkcija fibroznih ožiljaka bili su predmet stalne debate na terenu.
Nedavna studija koju su vodili prof. Dai Jianvu i Zhao Iannan sa Instituta za genetiku i razvojnu biologiju Kineske akademije nauka koristili su kombinaciju praćenja loza i jednoćelijskog sekvenciranja RNK (scRNA-sek) kako bi pokazali heterogenu distribuciju, izvor i funkciju meningealnih fibroblasta i perivaskularni fibroblasti u fibroznim ožiljcima.
Njihovo istraživanje objavljeno je u časopisu Nature Communications.
Prethodne studije su objavile da kod nepenetrirajućih povreda kičmene moždine, miofibroblasti prvenstveno potiču od perivaskularnih fibroblasta (PF), dok kod penetrantnih povreda kičmene moždine, uglavnom nastaju od meningealnih fibroblasta (MF).
Međutim, određene studije sugerišu da i kod penetrirajućih i nepenetrirajućih povreda kičmene moždine, miofibroblasti u fibroznim ožiljcima pretežno potiču od GLAST+ tip A pericita.
Prethodno istraživanje je pokazalo da potpuno uklanjanje fibroznih ožiljaka često dovodi do velike šupljine i nije pogodno za popravku povreda. Nasuprot tome, delimično smanjenje ožiljaka može poboljšati regeneraciju aksona i funkcionalni oporavak, što ukazuje na postojanje heterogenosti u funkciji fibroznih ožiljaka nakon SCI.
„S obzirom na to da je PDFGRβ izražen iu pericitima i u fibroblastima, koristili smo PDFGRβ-CreER::R26-TdTomato transgene miševe da obogatimo PDFGRβ+ ćelije pre i posle SCI“, rekao je profesor Dai.
ScRNA-sek analiza je otkrila da PDFGRβ+ ćelije obuhvataju pericite/vSMC i fibroblaste, pri čemu se fibroblasti transformišu u miofibroblaste nakon SCI.
Tim je koristio Col1a2-CreER::R26-TdT miševe za obeležavanje fibroblasta, NG2-CreER::R26-TdT i Mih11-CreER::R26 miševe da bi pratio ćelijsku sudbinu pericita/vSMC.
Njihovi rezultati su dodatno potvrdili doprinos fibroblasta formiranju fibroznih ožiljaka i isključili doprinos pericita/vSMC.
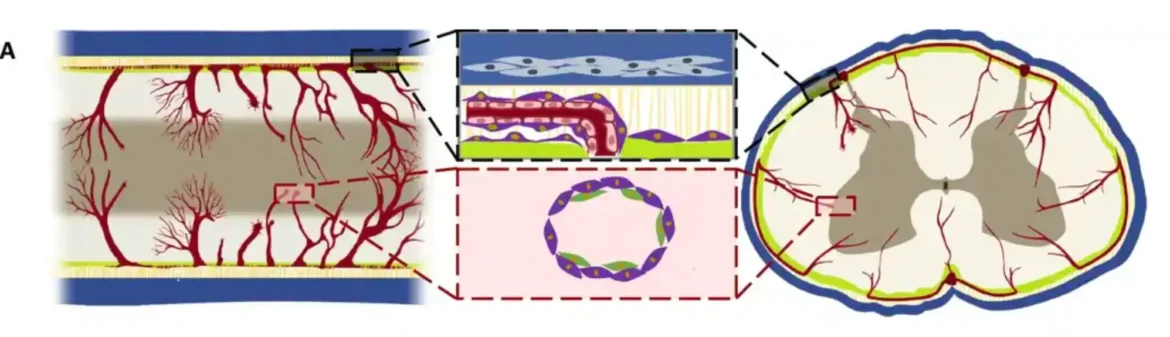
Fibroblasti su kasnije klasifikovani u Crabp2/Emb+ meningealne fibroblaste (CA-F) i Lama1/Lama2+ pia/perivaskularne fibroblaste (LA-F) na osnovu definisanih markera. Imunološko bojenje je pokazalo da se LA-F nalazi u parenhimskom perivaskularnom prostoru i meningama unutar CE-F u nepovređenoj kičmenoj moždini.
Nakon transekcije ili drobljenja SCI, CE-F je raspoređen u jezgru fibroznog ožiljka, okružen LA-F. Praćenje loze korišćenjem miševa Crabp2-CreER::R26-TdT potvrdilo je heterogenu distribuciju LA-F i MF izvedenog CE-F nakon SCI. CA-F je eksprimirao povišene nivoe gena povezanih sa sintezom holesterola i gena ekstracelularnog matriksa Col1a1 i Fn1, dok je LA-F eksprimirao visoko eksprimirane gene ekstracelularnog matriksa kao što su Col4a1 i Lama1.
Ovaj fenomen je sačuvan između miševa i majmuna.
Pored toga, scRNA-sek analiza i in vitro eksperimenti su pokazali da je LA-F umešan u transport lipida i angiogenezu.
Studija je razjasnila heterogenost u ćelijskom sastavu, poreklu, distribuciji i funkciji fibroznih ožiljaka nakon povrede kičmene moždine, dajući odgovore na dugogodišnja naučna istraživanja u ovoj oblasti i uspostavljajući teorijsku osnovu za specifičnu regulaciju fibroznih ožiljaka.