Terapeutika RNA interferencije (RNAi) privukla je značajnu pažnju u kliničkim istraživanjima zbog svog potencijala za lečenje različitih bolesti, uključujući genetske poremećaje, virusne infekcije i rak. Ovi terapeutici mogu da ciljaju i utišaju gene koji izazivaju bolesti sa visokom preciznošću, minimizirajući efekte van cilja i poboljšavajući ishode lečenja.
Kako se broj studija lečenja zasnovanih na RNAi širi, potrebno je odgovoriti na pitanja o tome koliko dugo mogu da traju koristi od RNAi i da li je moguće fino podesiti RNAi. Naučnici Univerziteta Merilend koristili su mikroskopske okrugle crve kao model za istraživanje mehanizama iza RNAi i kako se oni mogu optimizovati za medicinsku upotrebu kod ljudi. Tim je objavio svoje nalaze u časopisu eLife 20. avgusta 2024.
„Poslednjih godina, RNK interferencija je zaista izvršila uticaj na naučni svet jer se može koristiti za razvoj lekova koji selektivno utišuju gene koji izazivaju bolesti. Već ga vidimo na delu u sektorima poput poljoprivrede i neke RNAi terapije su već odobreno za ljudsku upotrebu“, rekao je stariji autor studije Antoni Hoze, vanredni profesor ćelijske biologije i molekularne genetike na UMD. „RNAi je veoma obećavajući, ali još uvek postoji mnogo fundamentalnih pitanja o tome kako učiniti RNAi efikasnijim.“
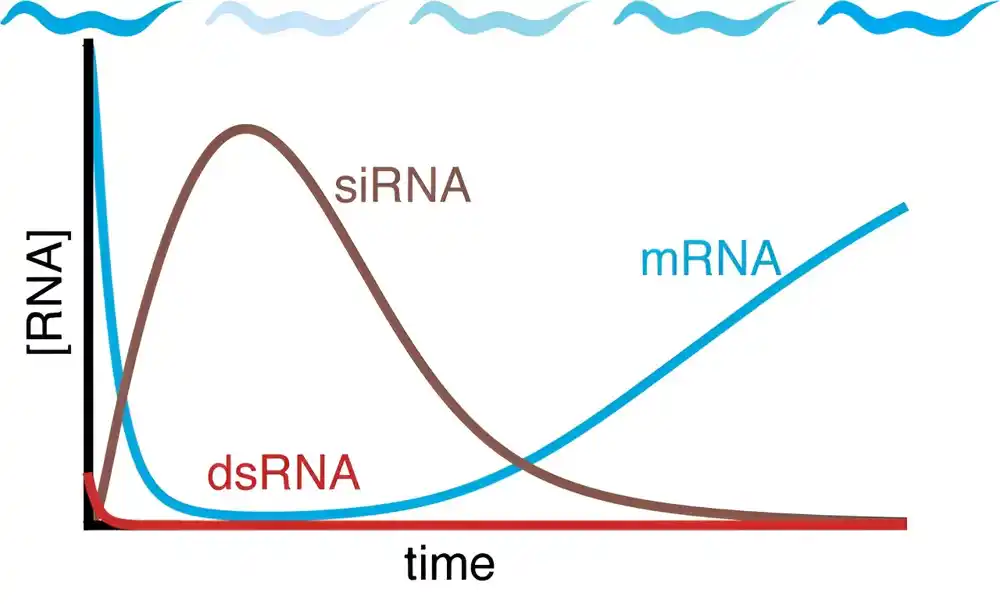
U studiji, Hoze i njegov tim su koristili kvantitativno modeliranje, simulacije i eksperimente sa okruglim crvima kako bi dublje zakopali u proces. Istraživači su otkrili da efekti utišavanja gena mogu vremenom da nestanu, ali su bili iznenađeni kada su saznali da su efekti na kraju nestali čak i u ćelijama koje se ne dele (ćelije koje se ne razmnožavaju i umnožavaju).
„Ima nekog smisla očekivati da ćelije koje se stalno dele mogu na kraju da razblaže lek zasnovan na RNAi“, objasnio je Hoze. „Ali prava stvar za grebanje je kako se efikasnost leka gubi čak i u ćelijama koje se ne dele. Iznenađujuće, ovo važi čak i za crve, gde se RNK pojačavaju – u suštini čineći više leka.
„Naš rad otkriva da mora postojati neki mehanizam koji degradira efekte RNAi tokom vremena – i istraživači moraju da uzmu taj mehanizam u obzir kada razvijaju rasporede doziranja za RNAi lekove kako bi mogli da održavaju efikasnost sve dok su potrebni.“
Ovi nalazi naglašavaju potrebu da se uzme u obzir otpornost na lekove kada se razvijaju tretmani zasnovani na RNAi, kaže Jose. Baš kao što bakterije mogu postati otporne na antibiotike, tako i mi možemo vremenom postati otporni na utišavanje.
„Ako ne uzmemo u obzir faktore kao što je dugovečnost naših RNK intervencija, onda ćemo zauvek stvarati tretmane koji će na kraju prestati da rade“, primetio je Hoze. „Umesto toga, moramo da razmotrimo otpor na samom početku razvoja leka i bolje razmislimo o tome na koje gene da ciljamo kako bi lek ostao efikasan onoliko dugo koliko je potrebno.
Studija je takođe ponudila nove uvide u to kako različiti regulatorni proteini unutar ćelija crva rade zajedno da kontrolišu utišavanje gena. Hozeov tim je istakao tri važna regulatorna proteina koji su uticali na utišavanje gena i otkrio da su oni obezbedili višestruke međusobno povezane puteve za kontrolu određenih ciljanih gena. Za istraživače, bolje razumevanje ovih mreža interakcija moglo bi dovesti do otkrića u finom podešavanju RNAi terapija za maksimalni uticaj na ljudske pacijente.
„Gubitak određenih proteina može otežati utišavanje nekih gena, ali ne i drugih“, rekao je Jose. „Znanje kako ovi proteini rade zajedno da utiču na gene može napraviti razliku pri dizajniranju lekova prilagođenih pojedincu.“
Gledajući unapred, Hozeov tim planira da bliže istraži proces degradacije RNAi i identifikuje ključne karakteristike koje neke gene čine podložnijim utišavanju od drugih. Nadaju se da njihovo istraživanje utire put za poboljšanja ove nove, ali obećavajuće klase terapeutika.
„Naš krajnji cilj je da kataliziramo napredak ka snažnijim, trajnijim i prilagođenim terapijama za utišavanje gena za širok spektar bolesti“, rekao je Jose.