Istraživači sa Skolteha, Uralskog federalnog univerziteta i Instituta za fiziku metala Mihejeva, UB RAS, dali su fundamentalni teorijski opis važnih svojstava hemijskog vezivanja u materijalima – naime, atomska naelektrisanja i podela energije hemijske veze na jonske i kovalentne doprinose. .
Istraživački rad pruža ubedljivu osnovu za tradicionalnu sliku zasnovanu na pojmu elektronegativnosti. Uz to, studija takođe identifikuje anomalan i kontraintuitivan slučaj: poluprovodnički bor fosfid. Nalazi su objavljeni u časopisu The Journal of Chemical Physics.
Od ranog 20. veka, naučnici su pokušavali da objasne svojstva molekula i kristala u smislu hemijskih veza — privlačnih interakcija između atoma zbog nekog osnovnog ponašanja njihovih valentnih elektrona.
Otkrivene su različite vrste veza. U kovalentnoj vezi, na primer, dva atoma dele elektronski par koji ih drži zajedno. Možete da delite više od dva atoma, a kada je uključeno mnogo atoma, veza se naziva metalnom.
Poznat je i suprotan slučaj, gde dva ili više elektronskih para dele dva atoma. Takođe je moguće da se zajednički elektronski par pomeri ka atomu koji jače vuče toliko da formira dva suprotno naelektrisana jona koja se drže zajedno jonskom vezom – ekstremni slučaj polarne kovalentne veze.
„Razmotrite vezu koja drži zajedno atome u materijalu. Stepen do kojeg je ta veza kovalentna ili jonska, a samim tim i naelektrisanja atoma, uticaće na većinu svojstava materijala“, rekao je koautor studije, uvaženi profesor Artem R. Oganov, koji vodi Laboratoriju za otkrivanje materijala u Skoltehu.
„Problem je u tome što je tokom prošlog veka predloženo toliko načina da se definišu atomski naboji da ne postoji saglasnost o tome o čemu govorimo i koje su stvarne numeričke vrednosti.“
Neki pristupi definišu atomska naelektrisanja u smislu vidljivih svojstava materijala, kao što je količina energije potrebna za prekid veze. Drugi se oslanjaju na matematičku operaciju integracije distribucije elektronske gustine po zapremini atoma, pri čemu ni ova druga nije jednoznačno definisana.
Ipak, drugi pristupi rade sa talasnim funkcijama — fundamentalnim, ali neuočljivim kvantno-mehaničkim objektima. I ovde postoje brojni načini za analizu talasne funkcije.
„Naš sopstveni metod, čiji je glavni tvorac Vladimir Anisimov, renomirani fizičar kondenzovane materije, koristi formalni matematički opis takozvanih Vanijerovih funkcija da zameni elektronske orbitale u kristalu ili molekulu u smislu talasnih funkcija sličnih atomu, “, rekao je Oganov.
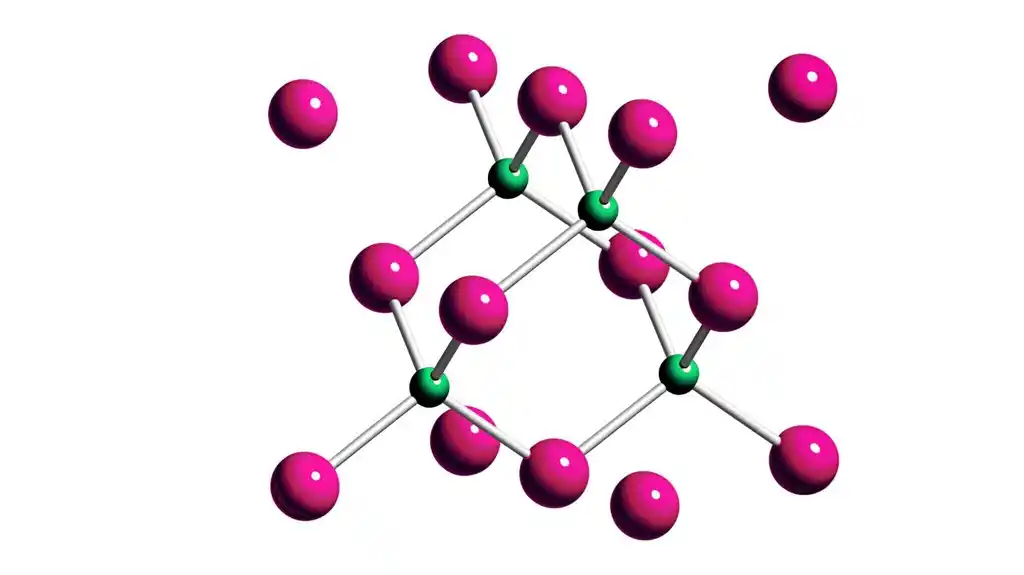
„Metoda omogućava da se atomski naboji i stepen kovalentnosti veze u odnosu na jonitet odrede na neempirijski način. Nalazi se dobro slažu sa opštom intuicijom hemičara, ali atomski naboji ekstrahovani za kristal bor fosfida (BP) su neočekivano“ obrnuto.'“
Poznato je da se sličan fenomen javlja u molekulu ugljen monoksida (CO), koji se sastoji od jednog atoma kiseonika i jednog atoma ugljenika. Sa svojom višom elektronegativnošću, moglo bi se očekivati da kiseonik ima jače privlačenje zajedničkog elektronskog para, što rezultira negativnim naelektrisanjem kiseonika i pozitivnim naelektrisanjem ugljenika.
U stvarnosti, situacija je obrnuta. Situacija je slična slučaju bor-fosfida: uprkos tome što fosfor ima veću elektronegativnost od bora, ovaj drugi završava sa negativnim naelektrisanjem. Zašto bi se to desilo?
U oba slučaja, objašnjenje je da se čini da atomi podnose energetski nepovoljan korak, čiji je krajnji kompromis obezbeđivanje jače kovalentne veze koja čini ceo ovaj potez energetski vrednim.
U ugljen monoksidu, inverzija naelektrisanja omogućava veoma jaku trostruku vezu između kiseonika i ugljenika. Da nije bilo te „manje energetske žrtve“, samo bi dvostruka veza bila održiva.
Slično, doniranjem jednog od elektrona fosfora boru, dva atoma efektivno imaju četiri valentna elektrona svaki na raspolaganju za izgradnju četiri kovalentne veze sa svojim susedima u kristalnoj strukturi. U suprotnom, i bor i fosfor bi mogli da uživaju samo u tri veze po atomu, što je na kraju energetski manje povoljno.
Zanimljivo je da je takva inverzija naelektrisanja u bor fosfidu predviđena pre dve decenije u takozvanim Born dinamičkim naelektrisanjem. Iako su to bile optužbe fizički veoma različite vrste, izgleda da je nešto očigledno „nazad“ u vezi sa sistemom bor-fosfor.
Metoda koju su predložili istraživači je univerzalna, pa će omogućiti bolje razumevanje prirode hemijskih veza u svim vrstama jedinjenja.