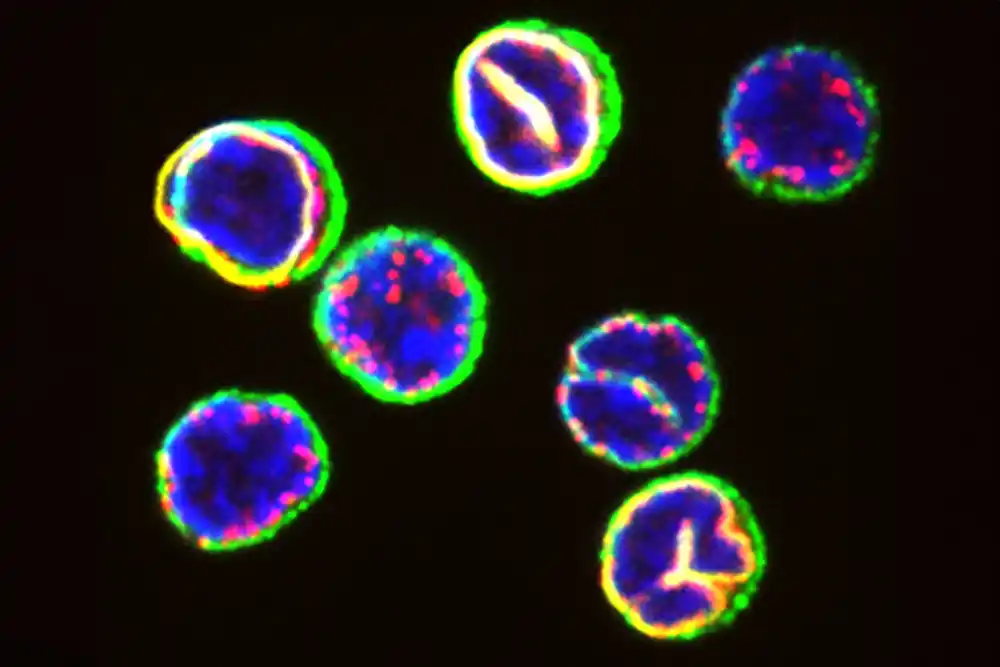
Postoji frustrirajuća činjenica o današnjim imunoterapijama za rak. Dok ponekad funkcionišu prelepo – potpuno eliminišući ili u velikoj meri smanjujući rak kod određenih pacijenata – drugi put uopšte ne funkcionišu. To je misterija.
Naučnici su postavili nekoliko hipoteza da objasne disparitet. Možda je to broj mutacija prisutnih u tumoru, sa više mutacija koje dovode do boljih odgovora. Ili je možda to okruženje tkiva koje okružuje tumor, pri čemu neka okruženja podržavaju, a druga potiskuju efikasne imune odgovore. Ali do sada, nijedno od ovih objašnjenja se nije pokazalo konačnim ili primenljivim u svim slučajevima.
Istraživači u Memorijalnom centru za rak Sloan Ketering (MSK) i Medicinskom koledžu Bejlor u Hjustonu, Teksas, sada misle da imaju bolje objašnjenje.
„Ispostavilo se da da bi imune ćelije efikasno ubijale ćelije tumora, one moraju da preuzmu specifičnu prostornu konfiguraciju“, kaže dr Andrea Šitinger, tumorski imunolog i član Imunološkog programa u MSK-u. Institut Sloan Kettering. „Treba da formiraju trijadu.
Trijada—što znači tri ćelije. Ali ne mogu samo bilo koje tri ćelije. Ono što vam je potrebno, objašnjava ona, su tri različite imune ćelije koje sarađuju zajedno u isto vreme i na istom mestu: jedna dendritička ćelija, jedna citotoksična („ubica“) T ćelija i jedna pomoćna T ćelija.
Ove ćelije nisu retke ili neobične, imunološki govoreći. Oni su standardni akteri opisani u bilo kom udžbeniku imunologije. Ali do sada, niko nije znao da ove ćelije moraju da budu fizički prisutne zajedno u tumorima kako bi se stvorio efikasan imuni odgovor protiv ćelija raka.
Otkriće, koje je objavljeno u časopisu Cancer Cell, ima neposredne terapijske implikacije i moglo bi da promeni način na koji lekari primenjuju imunoterapije.
Postdoktorski saradnik u Schietinger laboratoriji, dr Gabriel Espinosa-Carrasco, prvi je autor novog rada. Ono što je izazvalo radoznalost dr. Šitingera i dr. Espinose-Karaska u vezi sa ovom linijom istraživanja bili su obilni — i iskreno obeshrabrujući — podaci iz kliničkih ispitivanja na ljudskim ljudima adoptivnih terapija T ćelijama.
Ovo su terapije u kojima istraživači uzimaju uzorak citotoksičnih T ćelija od pacijenta, identifikuju one koje prepoznaju rak, zatim ih proširuju na milijarde kopija u laboratoriji i vraćaju pacijentu. (Alternativno, naučnici mogu da konstruišu T ćelije u laboratoriji da prepoznaju specifične ciljeve, a zatim ih prošire i unesu.)
Pristup zvuči logično; trebalo bi da radi, ali često ne radi.
„Kako je to moguće da možemo da generišemo najsavršenije citotoksične T ćelije u laboratoriji, da pacijentima damo milijarde ovih ćelija, a da ipak ne uspeju da eliminišu rak?“ pita dr Šitinger. „Čini se da postoji nešto toliko fundamentalno da nam nedostaje ono što citotoksične T ćelije treba da efikasno ubiju.“
U retrospektivi, kaže ona, odgovor se čini očiglednim.
Naučnici već dugo znaju da citotoksične T ćelije ne funkcionišu same. Potrebna im je pomoć pomoćnih T ćelija da bi se naoružali i aktivirali. „Ovo je udžbeničko znanje“, ističe dr Šitinger.
Zbog toga, kako objašnjava, svaki postojeći protokol gde se citotoksične T ćelije aktiviraju i pripremaju za adaptivnu T ćelijsku terapiju dodaje važne hemikalije koje prave T ćelije pomoćnice. U tom trenutku, razmišlja se, citotoksične T ćelije treba da budu spremne da se bore protiv raka kada se vrate u telo.
Ali šta ako je citotoksičnim T ćelijama potrebna pomoć pomoćnih T ćelija ne samo da bi se naoružale i aktivirale, već i da bi izvršile svoju misiju ubijanja? „Da li je citotoksičnim T ćelijama — poput Džejmsa Bonda — potrebna dozvola za ubijanje?“ pitao se dr Šitinger.
Da bi saznali, ona i njen tim su osmislili mišji model raka koji bi mogla da leči oblikom terapije T ćelija sličnim onima koje se trenutno koriste kod ljudi. Ona je postavila dve suprotne situacije. U jednom slučaju dala je miševima sa rakom samo citotoksične T ćelije. U drugom slučaju, dala je miševima i citotoksične T ćelije i pomoćne T ćelije. Rezultati su bili jasni i dramatični: samo miševi koji su primili oba tipa T ćelija videli su da njihovi tumori regresiraju.
„Ovo implicira da samo pokretanje i rad citotoksične mašinerije nije dovoljno za stvarno ubijanje“, kaže dr Šitinger. „Morate da im date dozvolu da ubiju ciljnu ćeliju.
Kako se to licenciranje može desiti postalo je jasnije kada su pod mikroskopom pogledali tumorska tkiva miševa. Tada su videli da su kod miševa koji su reagovali na tretman, njihove ćelije formirale karakteristične trijade imunih ćelija. Ćelije su bile fizički smeštene zajedno. Nekako, kaže dr Šitinger, taj prostorni raspored omogućava citotoksičnim T ćelijama da konačno dobiju poruku: vreme je da se preduzme akcija.
Bilo je to zanimljivo i uzbudljivo otkriće. Ali da li bi to bilo izvan određenog modela miša koji su koristili?
Da bi odgovorili na to pitanje, dr Šitinger i njen tim su se obratili kolegama sa Medicinskog fakulteta Bejlor, hirurzima Hiun-Sung Lee, MD, Ph.D., i Brian M. Burt, MD. Ta grupa je imala neobjavljene podatke o grupi pacijenata sa pleuralnim mezoteliomom, vrstom karcinoma pluća, koji su lečeni oblikom imunoterapije pod nazivom blokada imunološke kontrolne tačke. Unutar te grupe, neki od pacijenata su dobro reagovali na tretman, videvši kako im se tumori smanjuju, dok drugi nisu.
Kada su se hirurzi u Bejloru vratili da pogledaju uzorke tkiva koje su sakupili kao deo ispitivanja, otkrili su da oni pacijenti koji su reagovali na terapiju imaju karakteristične trijade u svojim tumorima. Oni koji se nisu odazvali nisu ih imali.
To je bio prilično ubedljiv dokaz da su imunološke trijade zaista važne, a ne samo slučajnost. Tri tipa imunih ćelija međusobno deluju na takav način da ih čini jačom borbenom silom protiv ćelija raka.
Koje su implikacije svega ovoga? Prvo, kaže dr Šitinger, postoji mogućnost da se ove trijade mogu koristiti kao biomarker za identifikaciju osoba koje će verovatno reagovati na imunoterapiju. Do sada, doktori nemaju dobre biomarkere da naprave tu razliku.
Drugo, rezultati impliciraju da bi lekari trebalo da ponovo razmisle o tome kako daju adoptivne terapije T ćelija. Umesto da daju pretežno T ćelije ubice, možda bi trebalo da uključe i pomoćne T ćelije; a možda bi i mnogo manje T ćelija ubica bilo dovoljno da u mešavini ima i T ćelija pomagača.
Na kraju, rezultati imaju implikacije na dizajn vakcina protiv raka, gde su fragmenti proteina povezanih sa rakom dizajnirani da pojačaju T ćelije ubice pacijenata.
Tim dr Šitingera radi na unapređenju istraživanja u svim ovim pravcima. Na primer, jedan član njenog tima, bioinženjer, dizajnira alate za povezivanje jedne T ćelije ubice sa jednom T ćelijom pomoćnicom, kako bi podstakao njihovo formiranje trijade sa dendritskom ćelijom (tip ćelije odgovoran za predstavljanje fragmenata proteina raka u T ćelije).
Oni takođe eksperimentišu sa novim formulacijama vakcina protiv raka i sarađuju sa drugim liderima u ovoj oblasti kako bi ovaj rad doveli do kliničkih ispitivanja.
„Glavna implikacija naših nalaza je da nije bitan apsolutni broj ćelija, već njihova prostorna konfiguracija“, kaže dr Šitinger. „Tri tipa ćelija moraju zajedno da budu na bojnom polju, a izgradnja terapeutika koji to rade je naš sledeći veliki cilj.“