Skoro dve decenije, kako rak bubrega postaje otporan na lekove za rapalog, zbunjuje naučnu zajednicu. Sada je studija koju su sproveli istraživači iz Programa za rak bubrega pri UT Southvestern Medical Center-u baca svetlo. Objavljena u časopisu PNAS, studija „Nekonvencionalni mehanizam delovanja i otpornost na rapaloge kod raka bubrega“ pruža dokaze o neočekivanoj ulozi netumorskih ćelija u posredovanju terapijskih efekata rapala kod raka bubrega.
Rapalozi (ili analozi rapamicina) se koriste za lečenje karcinoma bubrežnih ćelija (RCC) i drugih tipova tumora, ali je njihova upotreba otežana jer tumori vremenom postaju otporni. Zašto se to dešava, ostalo je nepoznato od kada su lekovi prvi put uvedeni za lečenje raka bubrega 2007. godine.
Otpor na ciljane terapije, kao što su rapalog, često uključuje mutacije u meti leka koje ometaju vezivanje leka. Međutim, mTOR, cilj leka, nije mutiran kada tumori RCC postanu otporni.
Da bi modelirali otpornost na rapaloge, istraživači u laboratoriji Brugarolas iskoristili su svoj program tumorgrafta, jedan od najvećih takvih programa širom sveta. Kao što su ranije radili kada su procenjivali rezistenciju na lekove koji blokiraju HIF2α (druga klasa lekova odobrenih od strane FDA za RCC), lečili su miševe transplantirane sa tumorima RCC pacijenata sa rapamicinom dok se rezistencija nije razvila. Dok se meta leka često ponovo aktivira kada se razvije otpornost, neočekivano, mTOR je ostao potisnut u tumorskim ćelijama.
Prethodni eksperimenti sa lekovima koji blokiraju HIF2α otkrili su da je otpornost na lekove rezultat mutacije u HIF2α koja mu je omogućila da ostane aktivan čak i u tumorskim ćelijama tretiranim lekovima, a isti rezultati su naknadno pronađeni i kod tumora pacijenata rezistentnih na lekove.
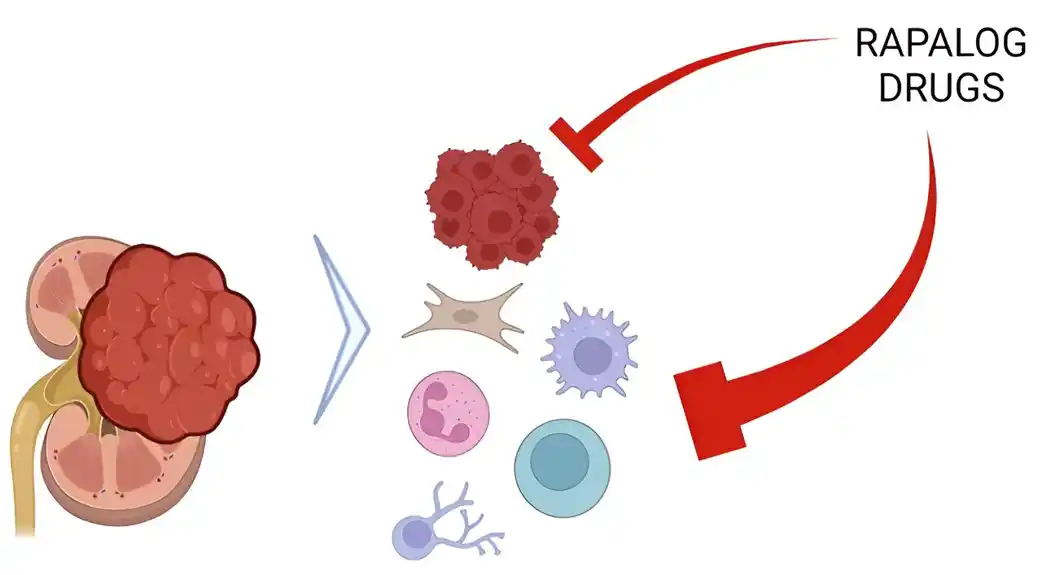
Međutim, kada se razvila otpornost na rapamicin, lek je i dalje blokirao aktivnost mTOR u tumorskim ćelijama. Međutim, zapanjujuće je da se mTOR ponovo aktivirao u ćelijama oko tumora, poznatim kao tumorsko mikrookruženje (TME).
Da bi utvrdili ulogu TME, istraživači su konstruisali miševe da naprave oblik mTOR koji je otporan na rapamicin. Istraživači su pretpostavili da ako je supresija mTOR u TME važna za rapalog aktivnost, tumori pacijenata treba da manje reaguju na lek kada se transplantiraju u ove miševe.
Istraživači su otkrili da je rapamicin bio daleko manje efikasan u ubijanju transplantiranih tumora RCC kod ovih miševa. Dakle, iako je mTOR bio lako inhibiran u transplantiranim ljudskim tumorskim ćelijama, neuspeh da se inhibira mTOR u TME, koji se razvija od miševa domaćina, prouzrokovao je rezistenciju na lekove.
Ove studije su spojile dva tradicionalna, ali različita pristupa modeliranju raka — transplantaciju tumora i genetski inženjering — i pokazale da TME igra ključnu ulogu u posredovanju aktivnosti rapala.
Nalazi otvaraju put za nove terapeutske strategije koje ciljaju na mikrookruženje tumora. „Proširenjem našeg pristupa ciljanju ćelija koje podržavaju tumor, možemo otvoriti nove puteve za borbu protiv rezistencije na lekove kod raka bubrega“, rekao je glavni autor dr Džejms Brugarolas, dr, profesor interne medicine u Odeljenju za hematologiju i onkologiju i osnivački direktor Programa za rak bubrega u Harold C. Simmons Comprehensive Cancer Center na UT Southwestern.