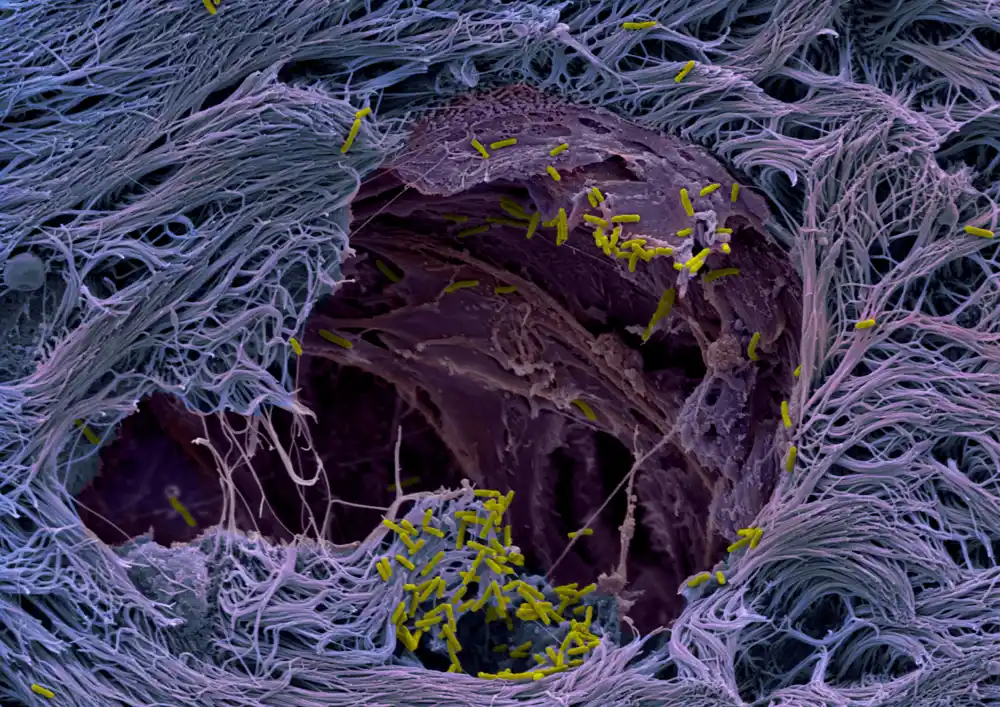
Kako patogeni napadaju pluća? Koristeći mikrotkiva ljudskih pluća, tim na Biozentrumu Univerziteta u Bazelu otkrio je strategiju koju koristi opasan patogen. Bakterija cilja specifične ćelije pluća i razvila je sofisticiranu strategiju da probije liniju odbrane pluća.
Ranije 2024. godine, SZO je objavila listu od 12 najopasnijih bakterijskih patogena na svetu koji su otporni na više antibiotika i predstavljaju ozbiljnu pretnju po ljudsko zdravlje. Ova lista uključuje Pseudomonas aeruginosa, bolnički patogen kojeg se mnogo plaše, a koji izaziva tešku i po život opasnu pneumoniju. Ovaj patogen je posebno opasan za imunokompromitovane pacijente i one na mehaničkoj ventilaciji, sa stopom mortaliteta do 50%.
Pseudomonas aeruginosa je razvila širok spektar strategija za invaziju na pluća i telo. Istraživači predvođeni prof. Ursom Jenalom sa Biozentrum, Univerzitet u Bazelu, sada su stekli nove uvide u proces infekcije koristeći mikrotkiva pluća uzgojenih u laboratoriji stvorenih od ljudskih matičnih ćelija.
U časopisu Nature Microbiology, oni opisuju kako Pseudomonas probija gornji sloj plućnog tkiva i napada dublje oblasti. Ova studija je sprovedena u okviru Nacionalnog centra kompetentnosti u istraživanju (NCCR) „AntiResist“.
Naša pluća su obložena tankim slojem čvrsto zbijenih ćelija koje štite dublje slojeve plućnog tkiva. Površina je prekrivena sluzom, koja zadržava čestice kao što su mikroorganizmi i specijalizovane ćelije ga uklanjaju iz disajnih puteva. Ovaj sloj služi kao efikasna, gotovo neprobojna barijera protiv invazijskih patogena. Međutim, bakterije Pseudomonas su pronašle način da ga probiju. Ali kako patogen prelazi tkivnu barijeru do sada je ostala misterija.
„Uzgajili smo mikrotkiva ljudskih pluća koja realno oponašaju proces infekcije unutar tela pacijenta“, objašnjava Dženal.
„Ovi modeli pluća su nam omogućili da otkrijemo strategiju infekcije patogena. Koristi peharaste ćelije koje proizvode sluz kao trojanske konje da napadnu i pređu barijerno tkivo. Ciljanjem peharastih ćelija, koje čine samo mali deo plućne sluzokože, bakterije mogu da probiju liniju odbrane i otvore kapiju.“
Sa velikim arsenalom faktora virulencije, poznatih kao sistemi sekrecije, patogen specifično napada i napada peharaste ćelije, replicira se unutar ćelija i na kraju ih ubija. Eksplozija mrtvih ćelija dovodi do ruptura u sloju tkiva, čineći zaštitnu barijeru nepropusnom. Patogeni iskorišćavaju ovu slabu tačku: oni brzo kolonizuju mesta rupture i šire se u dublje regione tkiva.
Koristeći organoide ljudskih pluća, naučnici su uspeli da razjasne sofisticirane strategije infekcije Pseudomonasom. Međutim, ostaje nejasno kako patogeni prilagođavaju svoje ponašanje tokom procesa infekcije. Na primer, oni prvo moraju da budu pokretni da bi se proširili po površini tkiva, zatim brzo prianjali za ćelije pluća nakon kontakta, a kasnije aktivirali svoje faktore virulencije. Poznato je da bakterije mogu brzo da promene svoje ponašanje zahvaljujući malim signalnim molekulima. Do sada, međutim, tehnologija za proučavanje ovih korelacija nije bila dostupna.
Dženalov tim je sada razvio biosenzor za merenje i praćenje malog signalnog molekula zvanog c-di-GMP u pojedinačnim bakterijama. Metoda je opisana u Nature Communications.
„Ovo je tehnološki proboj“, kaže Dženal. „Sada možemo da pratimo u realnom vremenu i sa visokom rezolucijom kako se ovaj signalni molekul reguliše tokom infekcije i kako kontroliše virulenciju patogena. Sada imamo detaljan pregled kada i gde pojedinačne bakterijske ćelije aktiviraju određene programe da regulišu svoje ponašanje. Ovo metoda nam omogućava da detaljnije istražimo infekcije pluća.“
„Zahvaljujući razvoju ljudskih plućnih organoida, sada imamo mnogo bolje razumevanje kako se patogeni ponašaju u ljudskom tkivu i verovatno kod pacijenata“, naglašava Dženal. „Ovo nas dovodi veliki korak bliže cilju NCCR AntiResist-a.
Organoidi ljudskih pluća i drugih organa kao što je bešika omogućavaju istraživačima da proučavaju efekte antibiotika u tkivu, na primer, identifikujući gde i kako bakterije preživljavaju tokom lečenja. Takvi modeli organa biće neophodni u budućnosti za razvoj novih i efikasnih strategija za borbu protiv patogena.