Pretvaranje CO₂ u gorivo i hemikalije korišćenjem električne energije, takođe poznato kao elektrohemijska konverzija CO₂, je obećavajući način za smanjenje emisija. Ovaj proces nam omogućava da koristimo ugljenik zarobljen iz industrije i atmosfere i pretvorimo ga u resurse koje obično dobijamo iz fosilnih goriva.
Da bi unapredili tekuća istraživanja efikasne elektrohemijske konverzije, naučnici sa Univerziteta Došiša uveli su isplativ metod za proizvodnju vrednih ugljovodonika iz CO₂. Studija je objavljena u časopisu Electrochimica Acta.
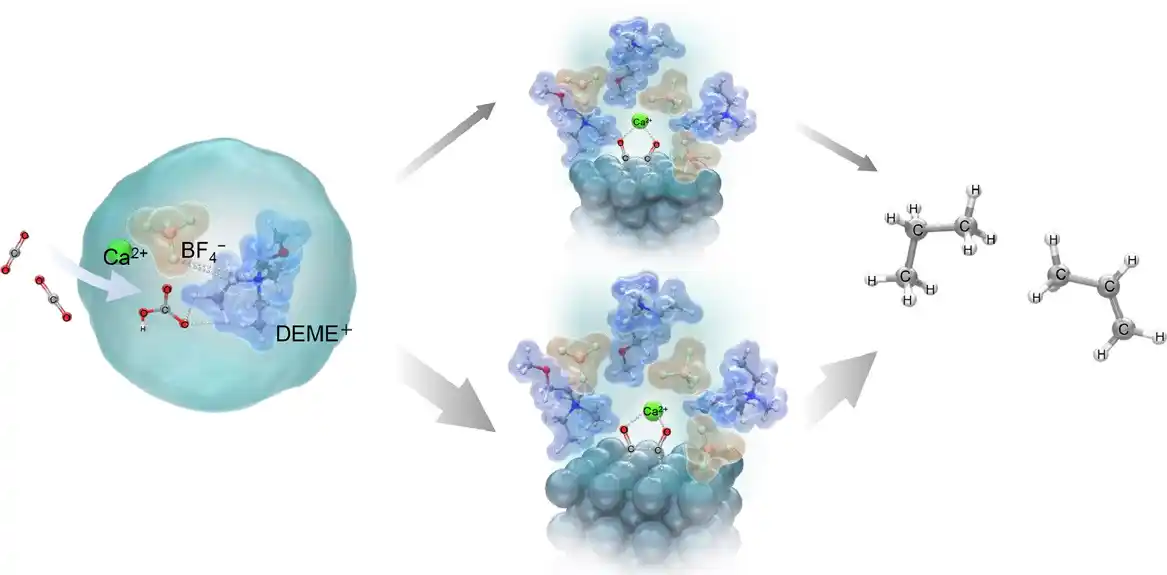
Istraživački tim, koji je predvodio profesor Takuia Goto, uključujući gospođu Saju Nozaki sa Visoke škole nauke i inženjerstva i dr Jutu Suzuki sa Instituta za naučna istraživanja Harris, proizveo je etilen i propan na osnovnoj srebrnoj (Ag) elektrodi koristeći jonska tečnost koja sadrži hidrokside metala kao elektrolit.
„Većina studija o CO₂ elektrolizi sa tečnim elektrolitom na sobnoj temperaturi fokusirala se na katalitička svojstva elektrode. U ovoj revolucionarnoj studiji, fokusirali smo se na elektrolit i uspeli smo da proizvedemo vredan ugljovodonični gas čak i na jednostavnoj metalnoj elektrodi“, kaže prof. Goto.
Jonske tečnosti nude jedinstvene prednosti za elektrohemijsko smanjenje CO₂. Oni rade u širokom opsegu napona bez raspadanja, nezapaljivi su i imaju visoke tačke ključanja. Ova stabilnost omogućava elektrolitu da izdrži visoke temperature nastale tokom egzotermne redukcije CO₂.
U svojoj studiji, istraživači su istraživali elektrohemijsku konverziju CO₂ i vode sa N, N-dietil-N-metil-N-(2-metoksietil) amonijum tetrafluoroboratom (DEME-BF 4 ) kao elektrolitom.
DEME-BF 4 elektrolit pruža optimalne uslove za maksimalno smanjenje CO₂. DEME + joni povećavaju rastvorljivost CO₂, omogućavajući većem broju molekula CO₂ da učestvuje u reakciji. Štaviše, zbog svoje hidrofilne prirode, joni vodonika potrebni za redukciju CO₂ u ugljovodonike mogu se lako obezbediti mešanjem elektrolita sa vodom.
Istraživači su utvrdili da se elektrohemijska konverzija CO₂ u ugljovodonike može povećati dodavanjem vodenih rastvora koji sadrže hidrokside metala kao što su kalcijum hidroksid (Ca(OH) 2), natrijum hidroksid (NaOH) i cezijum hidroksid (CsOH) u elektrolit .
Hidroksidi u jonskoj tečnosti mogu da reaguju sa CO₂ da bi formirali bikarbonate (HCO 3 − ) i karbonate (CO 3 2 − ), dodatno povećavajući dostupnost CO₂ za učešće u elektrohemijskim reakcijama.
Pod elektrolizom na sobnoj temperaturi (298 K ili 25°C) u atmosferi CO₂, istraživači su uspešno redukovali CO₂ u etilen (C 2 H 4 ), etan (C 2 H 6 ), propilen (C 3 H 6 ) i propan (C3H8).
Oni su postigli najveću efikasnost struje za svaki proizvod koristeći DEME-BF 4 elektrolit pomešan sa vodom i koji sadrži Ca(OH) 2, sa efikasnošću koja je dostigla do 11,3% za propan i 6,49% za etilen. Ova efikasnost je nadmašila one dobijene sa drugim metalnim hidroksidima za preko 1000 puta.
Razlog za ovu visoku efikasnost je objašnjen korišćenjem Ramanove spektroskopije i proračuna teorije funkcionalne gustine (DFT). Ove analize su otkrile da bikarbonatni joni , nastali kada CO₂ stupa u interakciju sa OH – jonima u elektrolitu, stupaju u interakciju sa DEME + i BF 4 – jonima elektrolita i formiraju stabilnu strukturu [DEME + -BF 4 − -HCO 3 − -Ca 2+ ].
CO₂ i HCO 3 – vrste zatim se adsorbuju na površinu elektrode formirajući adsorbovane vrste CO – ads . Adsorbovani CO – joni zatim snažno stupaju u interakciju sa Ca 2+ jonima prisutnim u elektrolitu, formirajući dve različite međustrukture: jednu strukturu A, koja se sastoji od Ca 2+ jona koordinisanog sa dva CO – jona adsorbovana na tri atoma Ag, i druga Struktura B, gde je jon Ca 2+ koordinisan sa dva CO − jona adsorbovana na dva atoma Ag.
Ova interakcija sa Ca 2+ jonima je ključna jer povećava stabilnost adsorbovanih vrsta, čineći moguće naknadne elektrohemijske reakcije.
Među ovim strukturama, istraživači sugerišu da je struktura B stabilnija i da je preferirani put za etilen, dok struktura A vodi do proizvodnje propana.
„Pokazali smo da prilagođavanje elektrolita može dovesti do promena na molekularnom nivou u faznoj transformaciji CO₂ u rasutom rastvoru i na interfejsu elektroda/jonski tečni elektrolit i predložili proces koji omogućava sintezu jedinstvenih ugljovodonika kao što je C 3. kaže prof Goto.
Ovi nalazi bacaju svetlo na procese uključene u konverziju CO₂ na granici između elektrolita na bazi jonske tečnosti i metalnih elektroda, kao što je uloga jona kalcijuma. Ovakvi uvidi mogu pomoći u razvoju elektrolita za efikasnu proizvodnju korisnih ugljovodonika iz CO₂.
„Fizičko-hemijsko znanje o ovom novom putu od razlaganja CO₂ do sinteze korisnih ugljovodonika, kao što je otkriveno u ovoj studiji, biće od ključnog značaja za unapređenje tehnologije korišćenja CO₂ i doprinos akademskom napretku u nauci o materijalima“, zaključuje prof. Goto.