Istraživači sa Klivlend klinike i IBM-a nedavno su objavili nalaze u časopisu Journal of Chemical Theori and Computation koji bi mogli postaviti temelje za primenu metoda kvantnog računarstva na predviđanje strukture proteina.
Decenijama, istraživači su koristili računarske pristupe za predviđanje proteinskih struktura. Protein se sam savija u strukturu koja određuje kako funkcioniše i vezuje se za druge molekule u telu. Ove strukture određuju mnoge aspekte ljudskog zdravlja i bolesti.
Preciznim predviđanjem strukture proteina, istraživači mogu bolje da razumeju kako se bolesti šire i kako da razviju efikasne terapije. Postdoktorski saradnik Klivlendske klinike Brian Raubenolt, Ph.D. i istraživač IBM-a Hakan Doga, dr. predvodio je tim da otkrije kako kvantno računarstvo može poboljšati postojeće metode.
Poslednjih godina tehnike mašinskog učenja su napravile značajan napredak u predviđanju strukture proteina. Ove metode se oslanjaju na podatke o obuci (bazu podataka eksperimentalno utvrđenih struktura proteina) da bi se napravila predviđanja. To znači da su ograničeni brojem proteina koje su naučili da prepoznaju. Ovo može dovesti do nižeg nivoa tačnosti kada programi/algoritmi naiđu na protein koji je mutiran ili veoma različit od onih na kojima su obučeni, što je uobičajeno kod genetskih poremećaja.
Alternativni metod je simulacija fizike savijanja proteina. Simulacije omogućavaju istraživačima da pogledaju različite moguće oblike datog proteina i pronađu najstabilniji. Najstabilniji oblik je kritičan za dizajn leka.
Izazov je u tome što su ove simulacije skoro nemoguće na klasičnom računaru, izvan određene veličine proteina. Na neki način, povećanje veličine ciljnog proteina je uporedivo sa povećanjem dimenzija Rubikove kocke. Za mali protein sa 100 aminokiselina, klasičnom računaru bi bilo potrebno vreme jednako starosti univerzuma da iscrpno pretraži sve moguće ishode, kaže dr Raubenolt.
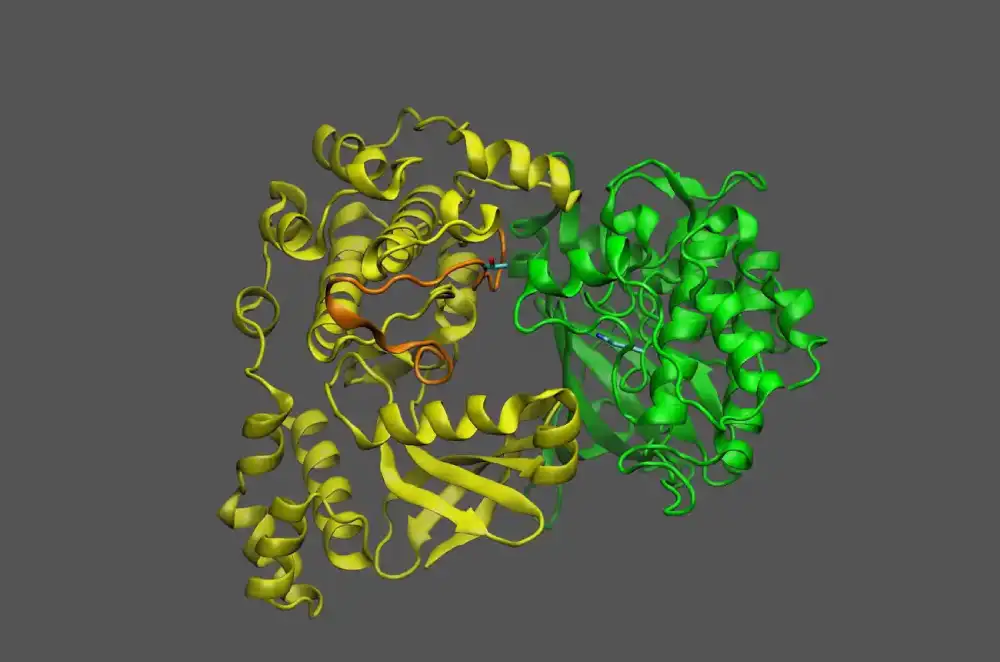
Da bi pomogao u prevazilaženju ovih ograničenja, istraživački tim je primenio mešavinu kvantnih i klasičnih računarskih metoda. Ovaj okvir bi mogao da omogući kvantnim algoritmima da se pozabave oblastima koje su izazovne za najsavremenije klasično računarstvo, uključujući veličinu proteina, unutrašnji poremećaj, mutacije i fiziku uključenu u savijanje proteina. Okvir je potvrđen tačnim predviđanjem savijanja malog fragmenta proteina Zika virusa na kvantnom računaru, u poređenju sa najsavremenijim klasičnim metodama.
Početni rezultati kvantno-klasičnog hibridnog okvira nadmašili su i klasičnu metodu zasnovanu na fizici i AlphaFold2. Iako je ovaj drugi dizajniran da najbolje radi sa većim proteinima, on ipak pokazuje sposobnost ovog okvira da kreira precizne modele bez direktnog oslanjanja na značajne podatke o obuci.
Istraživači su koristili kvantni algoritam da bi prvo modelirali najnižu energetsku konformaciju za kičmu fragmenta, što je obično računarski najzahtjevniji korak u proračunu. Klasični pristupi su zatim korišćeni za konvertovanje rezultata dobijenih iz kvantnog računara, rekonstrukciju proteina sa njegovim bočnim lancima i izvršenje konačnog preciziranja strukture sa poljima sile klasične molekularne mehanike.
Projekat pokazuje jedan od načina na koji se problemi mogu dekonstruisati na delove, sa kvantnim računarskim metodama koje se bave nekim delovima i klasičnim računarstvom za druge, radi veće preciznosti.
„Jedna od najjedinstvenijih stvari u vezi sa ovim projektom je broj uključenih disciplina“, kaže dr Raubenolt. „Stručnost našeg tima se kreće od računarske biologije i hemije, strukturne biologije, softvera i automatizacije, do eksperimentalne atomske i nuklearne fizike, matematike i, naravno, kvantnog računarstva i dizajna algoritama. Bilo je potrebno znanje iz svake od ovih oblasti da bi se stvorio računarski okvir koji može da imitira jedan od najvažnijih procesa za ljudski život“.
Kombinacija klasičnih i kvantnih računarskih metoda tima je suštinski korak za unapređenje našeg razumevanja proteinskih struktura i kako one utiču na našu sposobnost lečenja i prevencije bolesti. Tim planira da nastavi sa razvojem i optimizacijom kvantnih algoritama koji mogu predvideti strukturu većih i sofisticiranijih proteina.
„Ovaj rad je važan korak napred u istraživanju gde bi mogućnosti kvantnog računarstva mogle da pokažu prednosti u predviđanju strukture proteina“, kaže dr Doga. „Naš cilj je da dizajniramo kvantne algoritme koji mogu pronaći kako da predvide proteinske strukture što je realnije moguće.“