Istraživači su koristili računarske modele da bi razumeli šta pokreće akumulaciju proteina alfa-sinukleina, ključnog krivca za razvoj Parkinsonove bolesti.
Studiju, objavljenu danas kao Pregledani preprint u eLife-u, urednici opisuju kao pružanje važnih biofizičkih uvida u molekularni mehanizam koji leži u osnovi povezivanja alfa-sinukleinskih lanaca, što je od suštinskog značaja za razumevanje razvoja Parkinsonove bolesti. Analiza podataka je solidna, a metodologija može pomoći u istraživanju drugih molekularnih procesa koji uključuju intrinzično poremećene proteine (IDP).
Interno raseljena lica igraju važnu ulogu u ljudskom telu. Ovim proteinima nedostaje dobro definisana 3D struktura, što im omogućava da funkcionišu na fleksibilan način, usvajajući različite uloge po potrebi. Međutim, ovo ih takođe čini podložnim nepovratnoj agregaciji, posebno ako su mutirani. Poznato je da su ovi agregati povezani sa različitim bolestima, kao što su neurodegenerativne bolesti, rak, dijabetes i bolesti srca.
Na primer, Alchajmerovu bolest karakteriše agregacija amiloid-beta proteina, dok je Parkinsonova bolest povezana sa nagomilavanjem alfa-sinukleina.
„Sve veći broj dokaza je uspostavio vezu između intrinzično poremećenih proteina i razdvajanja faza tečnost-tečnost, ili LLLP-a, fenomena koji vidite ako pomešate ulje i vodu“, kaže glavni autor Abdul Vasim, dr. student na Tata institutu za fundamentalna istraživanja, Hajderabad, Indija. „Ovo je od interesa jer je poznato da LLPS sam formira subcelularne odeljke koji mogu dovesti do neizlečivih bolesti.“
Poznato je da alfa-sinuklein može da se podvrgne LLPS-u i da na agregaciju alfa-sinukleina utiče gužva iz obližnjih molekula i okolni pH. Međutim, karakterizacija preciznih interakcija i dinamike ovih sitnih agregatnih proteina je izazov.
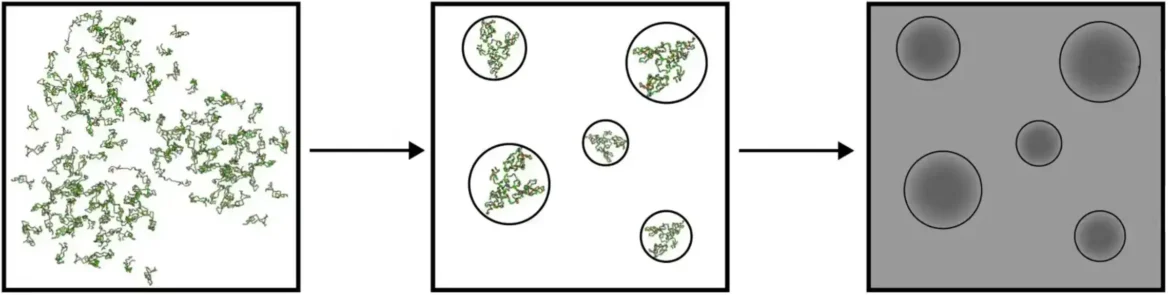
„Prethodni pokušaji su simulirali pojedinačne interno raseljene osobe, ali ove simulacije mogu biti izuzetno dugotrajne i zahtevne resurse, što čini proučavanje agregacije proteina nepraktičnim čak i sa najsavremenijim softverom i hardverom“, objašnjava stariji autor Jaganat Mondal, vanredni profesor na Tata. Institut za fundamentalna istraživanja. „Koristili smo grubo-zrnate molekularne dinamičke simulacije, koje su nam – iako nude nižu rezoluciju – omogućile da proučavamo agregaciju više interno raseljenih lica u mešavini.
Koristeći ovaj model, autori su simulirali kolektivnu interakciju mnogih alfa-sinukleinskih lanaca unutar kapljica pod različitim uslovima. Prvo, proučavanjem proteinskih lanaca pomešanih samo sa vodom, otkrili su da je oko 60% proteinskih lanaca ostalo slobodno i da nije pokazalo snažnu i spontanu tendenciju da se agregiraju zajedno.
Zatim su dodali neke „gužvaste“ molekule — velike biološke molekule koji životnu sredinu čine veoma pretrpanim prostorom za proteine. Prethodne studije o Alchajmerovoj bolesti pokazale su povećanu agregaciju proteina u prenaseljenom okruženju. Kao što se očekivalo, dodavanje gomile je dovelo do poboljšane agregacije alfa-sinukleina i smanjio se broj slobodnih proteina.
Slično tome, tim je otkrio da promena jonskog okruženja dodavanjem soli takođe podstiče agregaciju. Međutim, dalja istraživanja su otkrila da su ova dva faktora životne sredine — gužva i so — izazvali agregaciju različitim mehanizmima. Dodavanje soli u mešavinu povećalo je površinski napon kapljica, ali dodavanje molekula gomile nije imalo efekte površinske napetosti.
Ovo je važno znati jer što je veći površinski napon, veća je tendencija proteina da se agregiraju. Štaviše, spajanje kapljica radi ublažavanja površinske napetosti se često vidi u kapljicama odvojenim od tečne i tečne faze (LLPS), karakterističnim za bolesti koje uključuju poremećene proteine.
Karakteristika LLPS-a je da proteinski molekuli unutar kapljica usvajaju produženi oblik i svi se orijentišu u doslednom pravcu. Dakle, tim je zatim krenuo da vidi da li je to istina u okviru njihovih simulacija.
Otkrili su da proteini u gustoj (visoko koncentrisanoj) fazi razdvajanja tečnost-tečnost zaista imaju produženi oblik, bez obzira da li su prisutni molekuli gomile ili soli – svi proteinski molekuli imaju slične orijentacije – što sugeriše da IDP alfa-sinukleina imaju obeležja fenomena LLPS.
Zatim je tim želeo da otkrije kako različiti proteini alfa-sinukleina međusobno deluju da bi postigli ove efekte. Proučavajući položaj i karakteristike različitih aminokiselina unutar proteina, mogli su da utvrde šanse da dođu u kontakt pod različitim uslovima. Ovo je otkrilo da određene aminokiseline u proteinu verovatno postoje da spreče agregaciju – i da se proteini orijentišu da minimiziraju interakcije između ovih ostataka.
Urednici primećuju da postoje ograničenja za studiju koja treba da se pozabavi. Naime, kažu da bi se benčmarking simulacija u odnosu na druge metode mogao poboljšati kako bi čitaocu dalo veće poverenje u iznete zaključke.
„Zajedno, ovi rezultati sugerišu da i molekuli crovdera i so poboljšavaju agregaciju alfa-sinukleina, dok takođe stabilizuju nastale agregate“, kaže Vasim. „Bez obzira na faktore koji izazivaju agregaciju, interakcije koje pokreću formiranje kapljica ostaju iste.“
„Naša studija se fokusirala na normalan alfa-sinuklein i identifikovala ključna mesta unutar proteina koja su ključna za agregaciju“, zaključuje Mondal. „Smatra se da nasleđene mutacije u alfa-sinukleinu značajno povećavaju verovatnoću agregacije. Ove mutacije, koje uključuju manje promene u sekvenci proteina, naglašavaju važnost razumevanja molekularne osnove ovog procesa.“