Novo istraživanje naučnika sa Instituta za neuronauke Vu Tsai na Univerzitetu Stanford identifikovalo je ključni pokretač mijelinizacije, formiranje zaštitnih masnih ovojnica oko nervnih vlakana.
Mijelinizacija je neophodna za brz prenos električnih signala u mozgu, olakšavajući sve od pokreta do misli. Slom ili gubitak ove mijelinske ovojnice, kao što se vidi u stanjima kao što su multipla skleroza i druge neurodegenerativne bolesti, dovodi do značajnih kognitivnih i fizičkih oštećenja.
Nova otkrića su istraživače uzbuđena zbog potencijala za nove načine lečenja za ponovno rast ovih izolacionih omotača kod pacijenata sa demijelinizujućim poremećajima.
Istraživanje je objavljeno 14. marta 2024. u časopisu PNAS. Predvodili su ga interdisciplinarni postdoktoranti Instituta za neuronauke Vu Cai Tal Iram i Migel Garsija, a nadgledao je saradnik Instituta J. Bradlei Zuchero, docent na Odeljenju za neurohirurgiju.
Studija je usmerena na SRF (skraćeno od „faktor odgovora na serum“), faktor transkripcije koji je ranije bio poznat po svojoj ulozi u različitim ćelijskim procesima, ali nije u potpunosti shvaćen u kontekstu mijelinizacije.
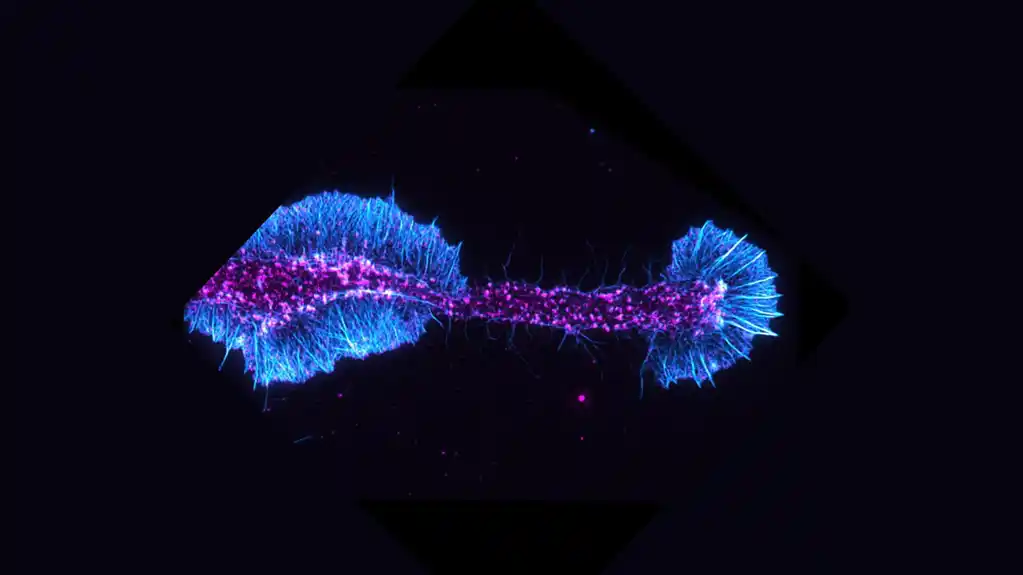
Kroz sofisticirane tehnike genetičke i molekularne biologije, uključujući ChIP-sek i RNA-sek analize, istraživački tim je identifikovao SRF kao ključni regulator gena uključenih u ćelijsku strukturu oligodendrocita – glijalnih ćelija odgovornih za mijelinizaciju nervnih vlakana u mozgu i kičmena moždina.
Da bi stvorili mijelin, oligodendrociti obavijaju nervna vlakna stotinama slojeva sopstvene masne ćelijske membrane, proširujući se na 25 do 50 hiljada puta svoje prvobitne površine u procesu. Ova jedinstvena sposobnost zavisi od sveobuhvatne reorganizacije strukturnih skela ćelija, posebno aktinskih filamenata koji su ključni za strukturu i kretanje ćelija.
„Ćelijska mašinerija potrebna za formiranje ovih složenih procesa mijelinizacije i napajanje ove sofisticirane ćelije je neverovatna“, rekao je Iram.
Da bi razumeli ulogu SRF-a u formiranju mijelina, tim je kreirao „nokaut“ modele – glodare kojima nedostaje SRF u oligodendrocitima njihovog mozga. Kod ovih životinja bez SRF-a, istraživači su primetili dramatično smanjenje nivoa aktinskih filamenata tokom ranih faza diferencijacije ćelija. Ovaj nedostatak je ometao sposobnost ćelija da formiraju mijelinski omotač oko aksona.
Istraživači su takođe bili iznenađeni kada su otkrili da je gubitak SRF-a pokrenuo potpis gena koji je ranije bio povezan sa starenjem i neurodegenerativnim bolestima kao što je Alchajmerova bolest.
„Najneočekivaniji nalaz bio je da se čini da SRF potiskuje transkripcioni potpis povezan sa bolešću“, rekao je Iram.
Ovo zapažanje povezuje nova otkrića sa Iramovim nedavnim otkrićem da se nivoi SRF-a oligodendrocita smanjuju sa godinama kod miševa – i da infuzija ostarelih životinja sa cerebrospinalnom tečnošću od mlađih miševa može podstaći aktivaciju SRF-a i sastavljanje aktina na nivoe mlađe.
„Verujemo da bi SRF nokaut miš mogao da oponaša ono što se dešava u ostarelom mozgu gde vidimo manje SRF u oligodendrocitima“, objasnio je Iram.
Ovo istraživanje ne samo da unapređuje fundamentalno razumevanje naučnika o tome kako se mijelin formira u mozgu u razvoju i zadržava svoj integritet u odraslom dobu, već takođe sugeriše da bi ciljanje na put gena SRF moglo biti obećavajući pristup lečenju poremećaja povezanih sa mijelinom.
Podsticanjem SRF aktivnosti, spekulišu istraživači, naučnici bi mogli da promovišu mijelinizaciju, da je zaštite od degradacije ili čak da je obnove u kontekstu starenja i neuroloških bolesti.
„Još uvek ima mnogo stvari koje ne razumemo o mehanizmima represije i koje su funkcionalne uloge ovih gena povezanih sa bolešću ili starenjem“, rekla je Iram, koja se sada bavi ovim pitanjima u sopstvenoj laboratoriji na Veizman institutu. nauke u Tel Avivu.