Rak, drugi vodeći uzrok smrti u svetu, verovatnije će reagovati na efikasan tretman ako se otkrije rano pre metastaziranja, što rezultira većom verovatnoćom preživljavanja.
Neki retki karcinomi nadmudruju ljudske intervencije i metastaziraju pre nego što budu otkriveni. Alveolarni sarkom mekog dela, ili ASPS, čini samo 0,01% svih karcinoma. Iako ASPS raste sporo, može se brzo širiti u telu, izbegavajući konvencionalnu hemoterapiju.
Da bi razumeli angiogeni mehanizam rasta krvnih sudova kancera, istraživači su se oslonili na modele koji koriste imunokompromitovane životinje koje su usađene uzorcima tumora dobijenim od pacijenata. Međutim, konvencionalne metode ograničavaju istraživače etičkim pitanjima i ne pružaju informacije o molekularnim mehanizmima kao što su međućelijske interakcije.
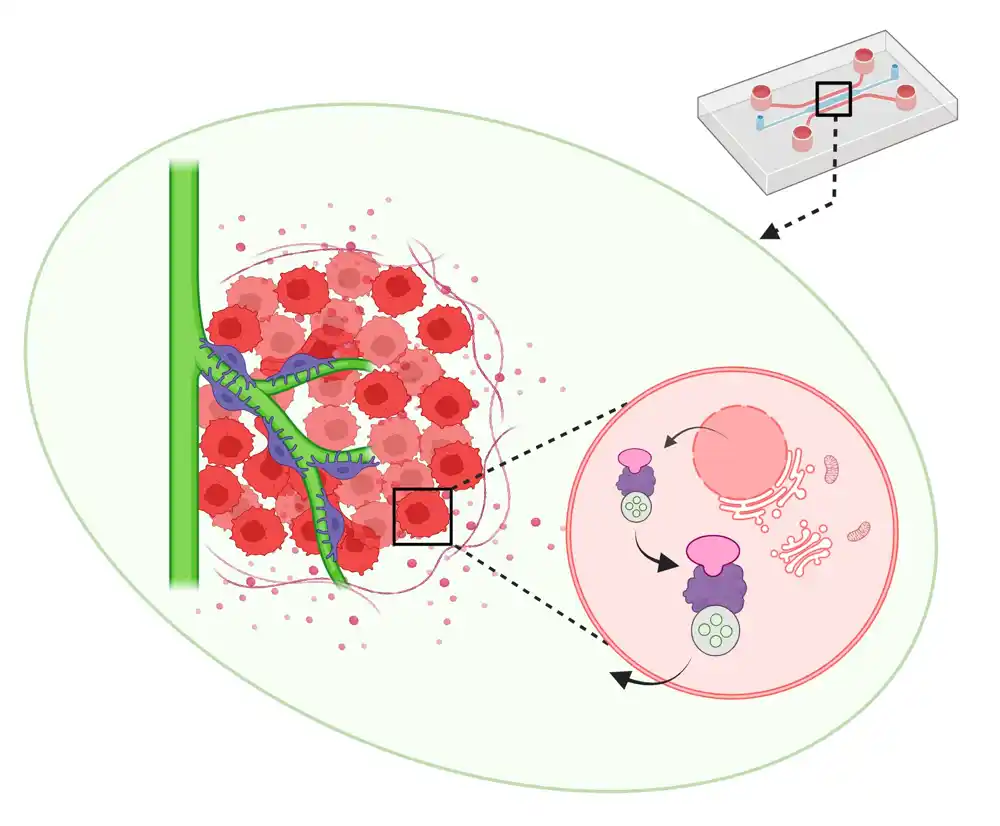
Sada je tim istraživača, uključujući Univerzitet Kjoto, razvio prvi ASPS-na-čipu, koji blisko imitira mikrookruženje tokom formiranja tumorskih sudova. Studija je objavljena u časopisu Proceedings of the National Academi of Sciences.
„Naš mikrofluidni ko-kulturni vaskulaturni čip bi trebalo da nam pruži uvid u angiogene mehanizme i moguće strategije za zaustavljanje rasta tumora kod pacijenata sa ASPS“, kaže glavni autor Surachada Chuaichob iz Odeljenja za mikro inženjering KjotoU (sada na KjotoU Institutu za naprednu energiju).
Tim je dizajnirao ovaj čip koji oponaša tumor da reprodukuje prirodne funkcije ljudskih endotelnih ćelija i pericita da formiraju krvne kapilare u početnoj fazi ASPS in vitro.
„Otkrili smo da se krvni sudovi sa pericitima, poznatim i kao angiogene klice, mogu indukovati sa poboljšanim rezultatima u 3D sferoidu napravljenom u potpunosti od ASPS tumorskih ćelija na čipu“, kaže vođa tima Riuji Iokokava na Odeljenju za mikro inženjering KjotoU.
„In vitro model pokazuje interakcije između ćelije i ćelije koje dovode do ASPS angiogeneze, što potvrđuje prethodne rezultate in vivo“, objašnjava koautor Takuro Nakamura sa Medicinskog univerziteta u Tokiju.
„Naša studija je takođe ključna u naglašavanju kritične uloge proteina Rab27a i Sitl2 u unutarćelijskom prometu i verifikaciji interakcija između ćelija u ASPS angiogenezi“, dodaje Miva Tanaka iz Japanske fondacije za istraživanje raka.
Iokokavin tim predviđa primenu njihovog modela ASPS-na-čipu kao alata za skrining za razvoj novih lekova suzbijanjem intracelularnog trgovanja proteinima kako bi se smanjila ASPS angiogeneza.
„Naš mikrofluidni ko-kulturni vaskulaturni čip mogao bi unaprediti naše proučavanje angiogenih mehanizama kod različitih karcinoma i razvoj personalizovanih tretmana“, napominje Jokokava.