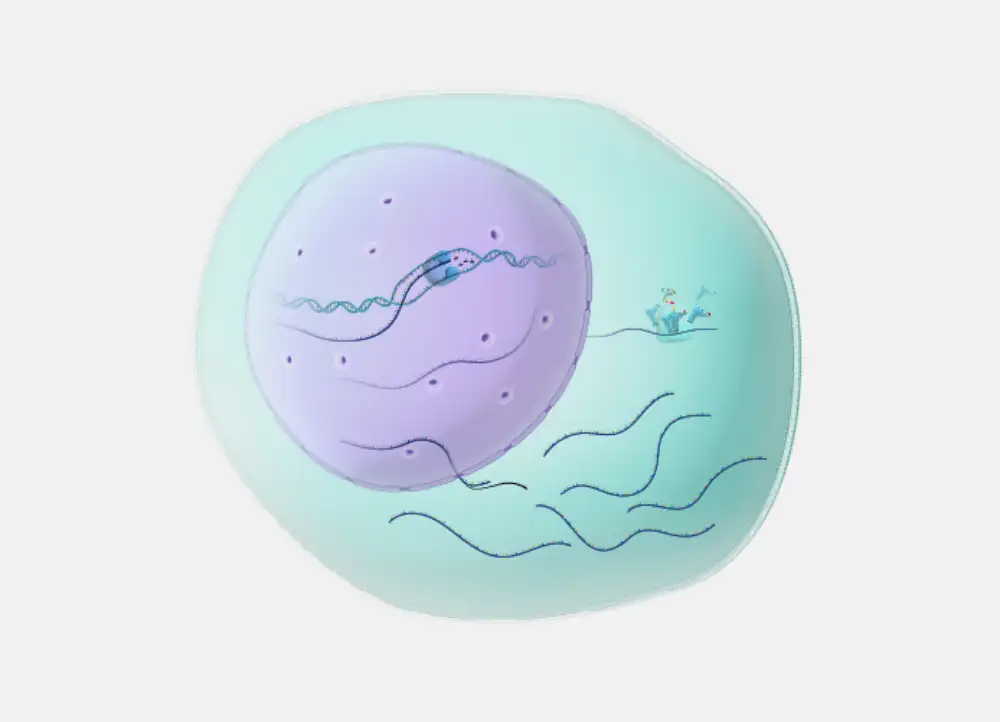
Messenger RNA (mRNA) napravila je veliki skok u žižu javnosti tokom pandemije, zahvaljujući svojoj ulozi temelja u nekoliko vakcina protiv COVID-19. Ali mRNA, koje su genetske sekvence koje upućuju telu da proizvodi proteine, takođe se razvijaju kao nova klasa lekova. Međutim, da bi mRNK imale široku terapeutsku upotrebu, molekuli će morati da traju duže u telu od onih koji čine COVID vakcine.
Istraživači sa Instituta Broad MIT-a i Harvarda i MIT-a konstruisali su novu strukturu mRNA dodavanjem više „repova“ molekulima koji su povećali nivoe aktivnosti mRNA u ćelijama za pet do 20 puta. Tim je takođe pokazao da su njihove mRNK sa više repa trajale dva do tri puta duže kod životinja u poređenju sa nemodifikovanom mRNK, a kada su ugrađene u CRISPR sistem za uređivanje gena, rezultirale su efikasnijim uređivanjem gena kod miševa.
Nove mRNA, objavljene u Nature Biotechnology, potencijalno bi se mogle koristiti za lečenje bolesti koje zahtevaju dugotrajne tretmane koji uređuju gene ili zamenjuju neispravne proteine.
„Upotreba mRNK u vakcinama protiv COVID-a je fantastična, što nas je navelo da istražimo kako bismo mogli da proširimo moguće terapeutske primene za mRNK“, rekao je Sjao Vang, viši autor novog rada, član osnovnog instituta u Broad-u i docent. hemije na MIT-u.
„Pokazali smo da neprirodne strukture mogu da funkcionišu mnogo bolje od onih koje se javljaju u prirodi. Ovo istraživanje nam je dalo puno poverenja u našu sposobnost da hemijski i topološki modifikujemo molekule iRNK.“
„Najviše sam uzbuđena činjenicom da ovaj novi oblik mRNK tako dobro toleriše ćelijske mašine za prevođenje“, rekao je Hongju Čen, prvi autor rada i diplomirani student hemije MIT-a u Vangovoj laboratoriji. „Ovo otvara mnoge nove mogućnosti za sintetičku modifikaciju mRNA kako bi se proširila njena terapeutska upotreba.“
mRNK u današnjim vakcinama protiv COVID-a je toliko efikasna jer je potrebno vrlo malo – kada se jednom ubrizga u telo, stimuliše proizvodnju proteina koji podsećaju na delove virusa COVID. „Imuni sistem je veoma robustan, tako da je u stanju da stvori mnoga antitela kao odgovor na prolaznu ekspresiju stranog proteina“, rekao je Čen.
Ali da bi isti tip mRNK proizveo dovoljno proteina za lečenje bolesti koje ometaju normalnu proizvodnju esencijalnih proteina, bila bi potrebna mnogo veća doza, što bi moglo da izazove toksične sporedne efekte.
Vangova laboratorija je specijalizovana za razumevanje kako RNK funkcioniše od vremena njene sinteze pa sve do konačne degradacije i odlaganja u ćelijama. Vang, Čen i njihov tim hteli su da preuzmu složen izazov dizajna strukture mRNA koja bi mogla biti stabilna, aktivna i proizvoditi trajne terapeutske efekte u malim dozama.
„Smatram da je mRNK veoma fascinantna jer kao informacioni molekul, njena funkcija je kodirana njenom sekvencom, dok je njena stabilnost diktirana hemijskim svojstvima njene kičme“, rekao je Čen. „Ova karakteristika daje hemičarima svestranost da opsežno konstruišu strukturu mRNA bez brige o promeni informacija koje ona nosi.
Na osnovu prethodnih istraživanja, Vang i Čen su znali da jedan deo strukture mRNK, grana koja se zove poli(A) rep, igra važnu ulogu u zaštiti mRNK od degradacije unutar ćelija. Godine 2022. su pokazali da hemijska modifikacija poli(A) repa usporava prirodno raspadanje mRNK, čineći ga korisnijim za širi spektar terapija. Oni su te modifikovane molekule nazvali „mRNA-oligo konjugati“ ili mocRNA.
Da bi se nadovezali na ovaj rad, Vang i Čen su pretpostavili da bi projektovanje još složenijeg oblika mRNK, koji sadrži više modifikovanih repova poli(A), još više poboljšalo terapeutske efekte mRNK.
U svom najnovijem pokušaju, tim je napravio svoje mRNK sa više repa, testirao ih u ljudskim ćelijama i otkrio da one održavaju translaciju mRNK mnogo duže od prirodne mRNA i mocRNA, proizvodeći do 20 puta više proteina po dozi tokom vremena.
U eksperimentima sa miševima, istraživači su otkrili da je samo jedna doza mRNK sa više repa dovela do proizvodnje proteina koja je trajala čak 14 dana – skoro duplo više od životnog veka koje su pokazale prethodne tehnologije mRNA.
Takođe su koristili svoju mRNA sa više repa da kodiraju protein Cas9 koji seče DNK kao deo sistema za uređivanje gena CRISPR-Cas9 i testirali su to na miševima da uređuju gene povezane sa visokim holesterolom, Pcsk9 i Angptl3. Otkrili su da samo jedna doza višestruke Cas9 mRNK može da izazove više nivoe uređivanja gena, što rezultira smanjenjem holesterola koji cirkuliše u krvotoku, u poređenju sa životinjama tretiranim kontrolnom Cas9 mRNK.
Vang i Čen su sada fokusirani na to da svoju sintezu i proces prečišćavanja sa više repova učine skalabilnijim. Oni takođe bliže razmatraju kako modifikacije mRNA utiču na međusobnu igru između njene terapijske stabilnosti i aktivnosti.
„Želimo da vidimo gde još možemo da konstruišemo strukturu mRNK da bismo povećali efikasnost“, rekao je Čen, dodajući da su zainteresovani i za modifikacije koje bi poboljšale brzinu kojom ćelije mogu da skeniraju i prevedu uputstva mRNK.