Proteini obavljaju biohemijske funkcije u našim telima tako što se vezuju za metabolite ili druge proteine da bi izvršili zadatke. Da bi se ovo uspešno uradilo, proteinski molekuli često menjaju oblik kako bi omogućili specifične interakcije vezivanja koje su potrebne za obavljanje složenih, preciznih hemijskih procesa.
Bolje razumevanje oblika koje proteini poprimaju dalo bi istraživačima važan uvid u zaustavljanje ili lečenje bolesti, ali trenutne metode za otkrivanje ovih dinamičnih, trodimenzionalnih oblika nude naučnicima ograničene informacije. Da bi se rešio ovaj jaz u znanju, tim iz Centra za napredna naučna istraživanja u CUNI Graduate Centru (CUNI ASRC) osmislio je eksperiment da testira da li bi izvođenje rendgenske kristalografije koristeći povišenu temperaturu u odnosu na povišeni pritisak otkrilo različite oblike.
Rezultati rada tima se pojavljuju u časopisu Communications Biology.
„Proteinske strukture ne miruju; one se pomeraju između nekoliko sličnih oblika, slično kao plesač“, rekao je glavni istraživač studije Daniel Keedi, dr., profesor u Inicijativi za strukturnu biologiju CUNI ASRC i profesor hemije i biohemije na The Citi College of Nev Iork i CUNI Graduate Center.
„Nažalost, postojeći pristupi za posmatranje proteina otkrivaju samo jedan oblik, ili sugerišu prisustvo više oblika bez davanja konkretnih detalja. Želeli smo da vidimo da li različiti načini probijanja proteina mogu da nam daju detaljniji uvid u to kako se menja oblik. .“
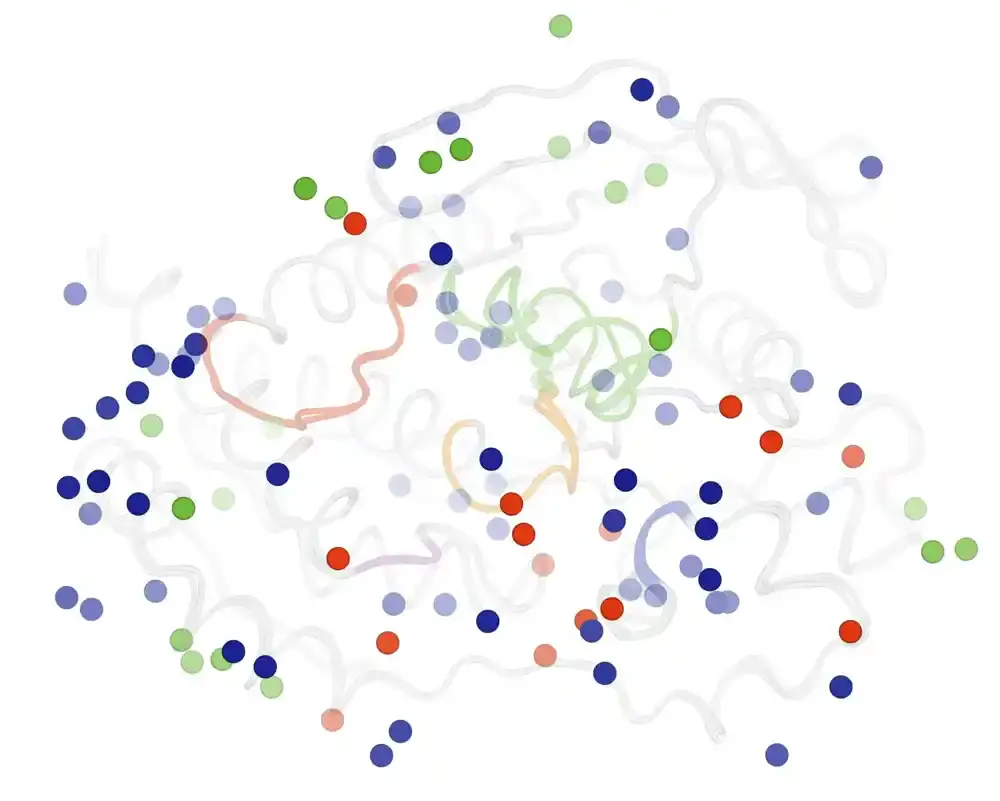
Za svoj eksperiment, tim je dobio kristale STEP-a, takođe poznat kao PTPN5 — ciljni protein leka za lečenje nekoliko bolesti, uključujući Alchajmerovu bolest — i uznemiravao ih koristeći ili visok pritisak (2.000 puta veći od atmosferskog pritiska Zemlje) ili visoku temperaturu (telo temperatura), od kojih se oba veoma razlikuju od tipičnih eksperimenata kristalografije na atmosferskom pritisku i kriogenoj temperaturi (-280 F, -173 C).
Istraživači su pregledali uzorke koristeći rendgensku kristalografiju i primetili da visoka temperatura i visok pritisak imaju različite efekte na protein, otkrivajući različite oblike.
Iako visok pritisak nije uslov koji proteini doživljavaju u telu, Keedi je rekao da je metoda agitacije izložila različita strukturna stanja proteina koja mogu biti relevantna za njegovu aktivnost u ljudskim ćelijama.
„Mogućnost korišćenja perturbacija kao što su toplota i pritisak da bi se razjasnila ova različita stanja mogla bi dati programerima lekova alate za određivanje kako mogu da zarobe protein u određenom obliku koristeći lek sa malim molekulima kako bi umanjili njegovu funkciju“, dodao je Keedi.