Proteini su radni konji ćelije, koji obavljaju funkcije da sve neometano funkcioniše. Neki proteini rade sami, ali u drugim slučajevima mnogi proteini se sastavljaju zajedno kako bi stvorili složenu mašinu. Ovi proteini su u stanju da rade više kooperativno nego što bi mogli sami, na isti način na koji je jedan motor moćan, ali ni približno toliko koristan kao motor u kombinaciji sa drugim delovima za pravljenje automobila.
Uputstva za izgradnju svakog pojedinačnog proteina potiču iz DNK, ali istraživači ne razumeju u potpunosti kako ćelije regulišu sastavljanje mnogih proteina u veću mašinu. Ne samo da ćelije moraju tačno da sastavljaju svoju mašineriju, već to moraju da urade u tačno vreme i na tačnoj lokaciji da bi mašinerija mogla da izvrši svoj zadatak – u suprotnom, mašina može da pokvari ili izazove štetu jer radi svoj posao pogrešno.
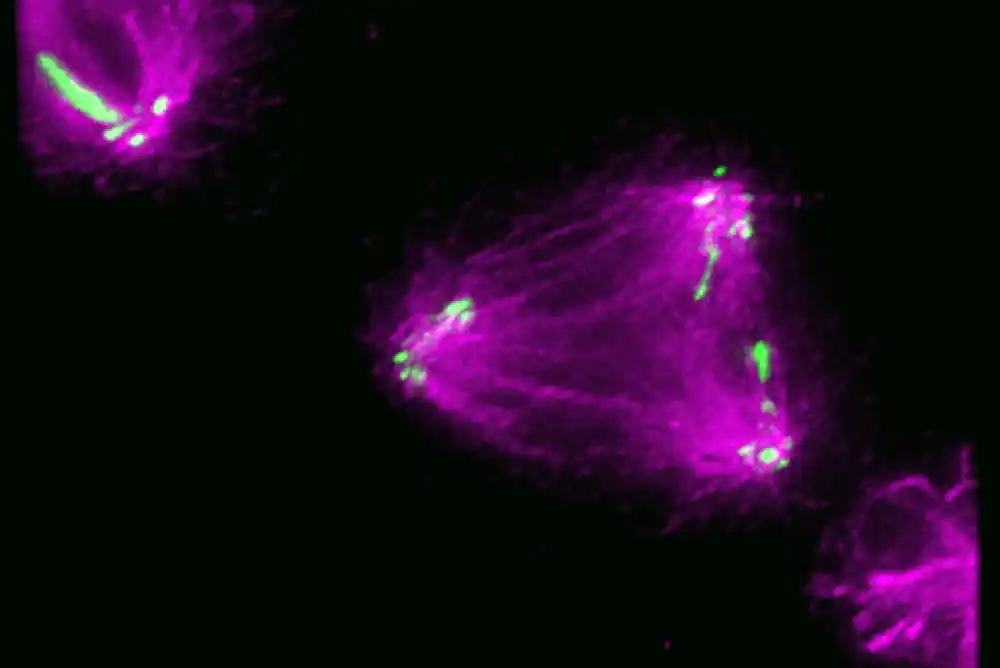
Jedan važan zadatak za koji se ćelija oslanja na složenu mašineriju je podela hromozoma tokom deobe ćelije. Kada se ćelija podeli, ona umnožava svoje hromozome, a zatim ih pažljivo organizuje i distribuira tako da svaka ćerka ćelija završi sa kompletnim i tačnim skupom hromozoma.
Tokom ćelijske deobe kod ljudi i mnogih drugih vrsta, parovi odgovarajućih hromozoma poređaju se u centru ćelije. Ćelijska mašinerija se sastavlja u centralnoj tački na svakom hromozomu zvanoj centromera da odvoji dva hromozoma u svakom paru koji se podudara i povuče ih na suprotne krajeve ćelije, gde se spajaju sa onim što će postati dve ćerke ćelije.
Ako se mašina ne sastavi tačno na centromeri, može da pocepa hromozome ili ih pogrešno sortira u nove ćelije. Ove greške mogu ubiti ćelije ili stvoriti defekte koji mogu doprineti bolesti.
Mašina koja se vezuje za centromeru i pomaže u pravilnom sortiranju i transportu hromozoma naziva se kinetohor. Kod ljudi, to je ogroman kompleks sastavljen od mnogih kopija mnogo različitih proteina. Uprkos važnosti lokacije kinetohora za pravilnu podelu ćelija, istraživači nisu znali kako ćelije kontrolišu gde se na hromozomima kinetohor sastavlja.
Član Instituta Vajthed Iain Cheeseman, tadašnji diplomirani student u njegovoj laboratoriji Gunter Sissoko, vanredni profesor Perelman na Univerzitetu Pensilvanije Ekaterina Grishchuk, i diplomirani student u njenoj laboratoriji Ekaterina Tarasovec razvili su skup alata koji im je omogućio da reše ovu misteriju , kao što je detaljno objavljeno u časopisu Nature Cell Biologi 2. januara.
Istraživači su otkrili da je odlučujući faktor u tome gde se kinetohor sastavlja lokalna koncentracija molekula kinetohora. Dovoljno molekula mora biti blizu jedan drugog u istom prostoru da bi se pokrenulo sklapanje. Istraživači su to utvrdili tako što su razvili čestice slične kinetohorima koje su im omogućile da proučavaju aspekte interakcije velikog broja kinetohornih proteina kada su u neposrednoj blizini jedni od drugih u odnosu na one kada su daleko jedan od drugog.
„Nismo razumeli zašto kinetohor mora da bude veliki kompleks sa toliko kopija svojih mnogobrojnih komponenti“, kaže Sisoko. „Sada znamo da je gustina kinetohornih proteina koju ovo stvara neophodna za sklapanje cele strukture.“
Ovaj projekat je počeo sa zbunjujućim zapažanjem. Protein koji se zove CENP-A obeležava centromeru u svakom trenutku i čini samu osnovu kinetohora: svi ostali delovi strukture će se sastaviti na i oko CENP-A. Stoga bi se moglo pretpostaviti da CENP-A određuje lokaciju kinetohorskog sklopa. Međutim, CENP-A se ponekad može naći izvan centromere.
Na primer, u ćelijama raka ili u ćelijama gde istraživači veštački povećavaju proizvodnju CENP-A, protein se može ugraditi negde drugde na krakove hromozoma, a kinetohori se ipak ne sklapaju na vrhu ovih zalutalih CENP-A molekula. Imalo je smisla da ako je CENP-A sklon curenju izvan centromere, ćelija mora imati neki drugi mehanizam za sprečavanje aberantnog sastavljanja kinetohora, jer bi rezultati mogli biti katastrofalni za ćeliju – ali koji je bio mehanizam?
Istraživači su sumnjali da se kinetohori mogu sastaviti samo na lokaciji koja ima visoku koncentraciju CENP-A, poput centromere, a ne na lokacijama koje imaju samo malo CENP-A. Poznato je da su i drugi procesi u ćeliji regulisani na sličan način. Molekuli se koncentrišu u istom malom prostoru da bi se olakšala njihova interakcija.
CENP-A je teško proučavati jer je ugrađen u hromozom, pa su da bi testirali ovu hipotezu, istraživači su odlučili da pogledaju CENP-T, protein koji je deo iste podstrukture kinetohora kao CENP-A. Zajedno, mnoge kopije te podstrukture formiraju unutrašnji kinetohor, koji služi za pričvršćivanje kompleksa na centromeru, a zatim regrutuje ili pokreće sklapanje spoljašnjeg kinetohora. CENP-T igra ključnu ulogu u regrutovanju spoljašnjeg kinetohora, koji povezuje hromozome sa mikrotubulama, ćelijskim autoputem koji se koristi za razdvajanje hromozoma.
Istraživači su stvorili ono što su u suštini bile velike kuglice CENP-T i drugih vezivnih molekula koje ne bi ometale njihovu funkciju. Ove lopte su ponovo stvorile gustinu CENP-T koja bi se mogla naći u kinetohoru. Takođe su stvorili još jedan konglomerat CENP-T u kojem su mogli precizno da kontrolišu broj CENP-T molekula u grupi, a zatim da mere kako različite grupe veličine utiču na sposobnost celine da regrutuje spoljne kinetohorne proteine.
„Radeći zajedno, naše laboratorije su uspostavile novi eksperimentalni sistem za rekreaciju ljudskih kinetohornih čestica“, kaže Tarasovec. „Ne samo da nam je ovo omogućilo da istražimo kako ćelije kontrolišu formiranje funkcionalnih kinetohora u određenim vremenima i lokacijama, već čestice služe i kao odličan alat za proučavanje drugih pitanja od interesa, kao što su mehanizmi kretanja hromozoma.“
Koristeći ove alate, istraživači su otkrili da je CENP-T bio mnogo bolji u vezivanju spoljnih kinetohornih proteina kada je okružen drugim CENP-T molekulima nego kada je jedan CENP-T radio sam – i isto tako, da su veće grupe CENP-T bile bolje od male grupe. Svaki CENP-T molekul je u stanju da direktno veže dva molekula NDC80, kritične komponente spoljašnjeg kinetohora.
Kada su istraživači pogledali CENP-T u velikoj grupi, u proseku svaki CENP-T je vezao maksimalan broj NDC80 molekula. Međutim, kada su pogledali CENP-T molekule koji rade sami, većina pojedinačnih CENP-T molekula nije uspela da veže čak ni jedan NDC80.
„Postoji regulatorni prekidač koji se okreće kada unutrašnji kinetohor regrutuje dovoljno CENP-T, što omogućava CENP-T da regrutuje spoljašnji kinetohor“, kaže Cheeseman, koji je takođe profesor biologije na Tehnološkom institutu u Masačusetsu. „Kada imate taj protein sam po sebi, on i dalje ima sve te vezujuće interfejse, ali ih ne koristi. Kada dostignete taj prag gustine CENP-T, odjednom on zaista može da pokrene formiranje ovih struktura.“
Čestice koje su istraživači stvorili funkcionišu toliko slično ljudskim kinetohorima da istraživači nameravaju da ih koriste da odgovore na više pitanja o funkciji kinetohora. Nadaju se da će i drugi istraživači takođe iskoristiti svoj pristup za proučavanje kinetohora ili, šire, istražiti kako lokalna koncentracija različitih proteina utiče na njihovu funkciju. Istraživači takođe rade na otkrivanju mehanizma kojim CENP-T postaje bolji u vezivanju NDC80 kada je okružen drugim CENP-T molekulima.
„Iako je opšte poznato da se kinetohori okupljaju zbog vezivanja proteina kao što su NDC80 i CENP-T u određenoj sekvenci, naša studija je otkrila divno iznenađenje. Proces nije tako jednostavan kao što se čini, a vezivanje NDC80 za CENP-T zavisi od toga da li je CENP-T u grupisanom obliku“, kaže Grishchuk. „Uzbuđeni smo što saznajemo više o osnovnom molekularnom mehanizmu.“