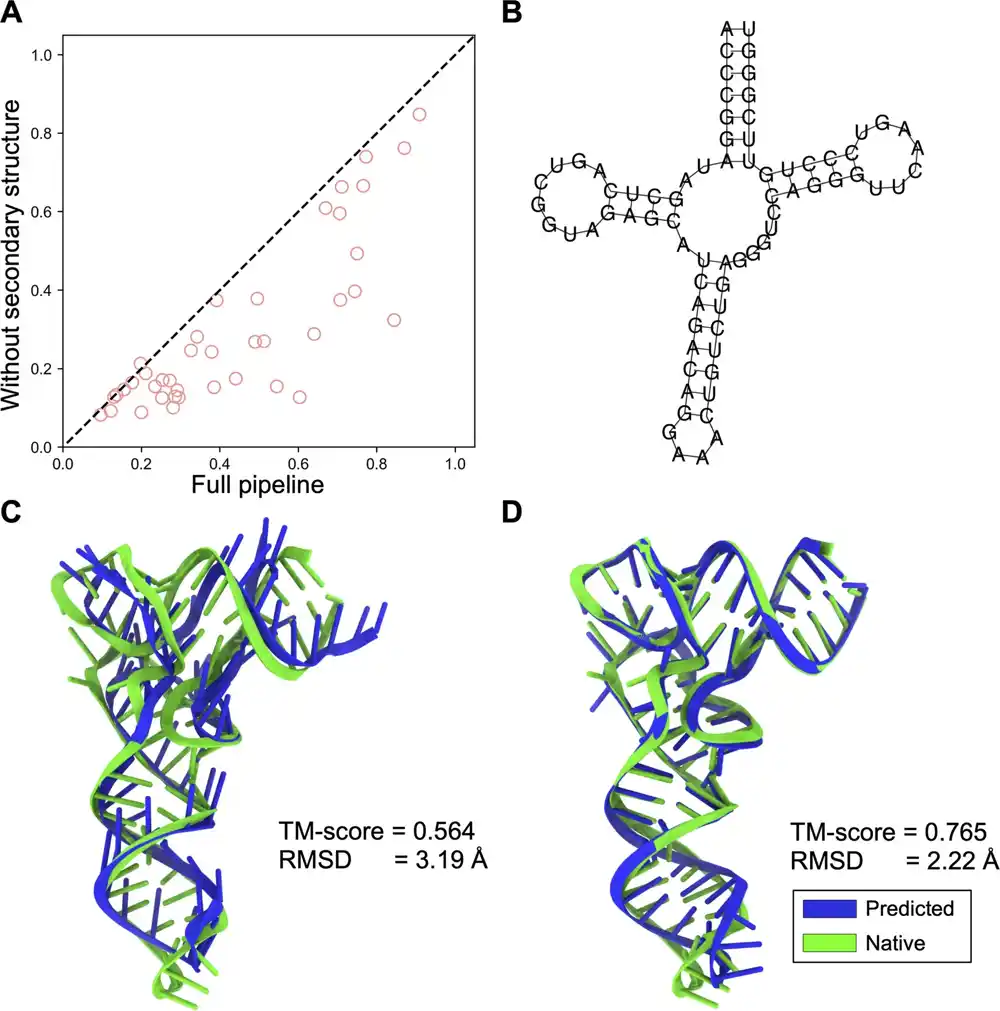
Istraživački tim sa Singapurskog instituta za nauku o raku (CSI Singapur) na Nacionalnom univerzitetu Singapura (NUS) uspešno je iskoristio veštačku inteligenciju (AI) i tehnike dubokog učenja za modeliranje RNK 3D struktura na atomskom nivou iz primarnih RNK sekvenci. Nazvan DRfold, ovaj novi metod zasnovan na veštačkoj inteligenciji poboljšava tačnost RNK modela za više od 70%, u poređenju sa tradicionalnim pristupima.
Tim, koji predvodi profesor Zhang Iang iz CSI Singapura i NUS School of Computing, objavio je svoje nalaze u Nature Communications 16. septembra 2023.
RNK su veliki biomolekuli koji se sastoje od jednog lanca nukleotida, koji svoj redosled izvode iz dvolančanih DNK molekula tokom transkripcije. RNK su nadaleko poznate po svojoj ulozi u procesima transkripcije i translacije, što olakšava transfer informacija o genima oličenih u DNK sekvencama u sekvence proteinskih aminokiselina.
Poslednjih godina otkriveno je da RNK igraju važnu ulogu u regulisanju različitih bioloških procesa, pa ih stoga pozicioniraju kao nove mete lekova.
Procenjeno je da će ciljanje RNK sa malim molekulima eksponencijalno proširiti pejzaž dizajna lekova, u poređenju sa tradicionalnim otkrivanjem lekova ciljanih na proteine. Shodno tome, biologija RNK i njene primene u razvoju novih terapeutika predstavljaju kritično novo polje, prikupljajući značajne akademske i industrijske investicije širom sveta.
U poređenju sa dobro savijenim proteinskim strukturama, RNK strukture i njihovi nabori se generalno smatraju manje stabilnim zbog relativno plitkog energetskog pejzaža. Stoga, tradicionalna polja sile zasnovana na fizici i statistici, koja su često sklona greškama, ne mogu tačno da opišu elegantne i zamršene interakcije savijanja RNK
U međuvremenu, ograničena dostupnost eksperimentalnih RNK struktura u Protein Data Bank (PDB) dodatno ograničava tačnost ovih tradicionalnih polja sila zasnovanih na znanju, koja su izvedena iz statistike PDB struktura.
Da bi se suočio sa ovim izazovima, DRfold je kreirao dva komplementarna mrežna kanala dubokog učenja – jedan je fokusiran na učenje od kraja do kraja, a drugi na učenje geometrijskih ograničenja. Ovaj inovativni pristup značajno je poboljšao tačnost polja sile zasnovanog na veštačkoj inteligenciji. Sinergističko spajanje ove dve mreže je takođe dodatno poboljšalo tačnost potencijala AI zasnovanih na jednoj neuronskoj mreži.
Ključna inovacija leži u uvođenju pristupa dubokog učenja za predviđanje tercijarne strukture RNK. Dok su se tradicionalne metode oslanjale na homologno modeliranje ili simulacije savijanja zasnovane na fizici, koje pate od ograničenja tačnosti polja sile, DRfold koristi mreže transformatora samopažnje da predvidi 3D strukture iz RNK sekvenci, označavajući revolucionarni pomak u rešavanju ovog ključnog izazova.
DRfold-ova nova strategija integracije dve paralelne i komplementarne mreže izgrađene na učenju od kraja do kraja i geometriji pomaže da se poboljša tačnost predviđanja potencijalne funkcije i RNK modela, čineći ga laganim, veoma fleksibilnim, skalabilnim i stoga preferiranim metodom predviđanja .
Dr Li Jang, naučnik u CSI Singapuru i prvi autor ove studije, rekao je: „Pošto biološke funkcije RNK zavise od specifičnih tercijarnih struktura, postaje sve važnije i neophodno odrediti 3D strukture RNK kako bi se olakšati označavanje funkcija zasnovanih na RNK i otkrivanje lekova.“
On je dodao: „Zlatni standard u strukturnoj biologiji, kao što je korišćenje biofizičkih eksperimenata — rendgenska kristalografija, kriogena elektronska mikroskopija (Crio-EM) i spektroskopija nuklearne magnetne rezonance (NMR) — za određivanje RNK struktura, često su troškovi i radno intenzivan, ograničavajući njihovu primenu na mali deo poznatih RNK.“
„Trenutno postoji više od 30 miliona poznatih RNK sekvenci u centralnoj bazi podataka RNK, ali samo manje od 500 (ili 0,0017%) ima eksperimentalno rešene strukture. Ovo frustrirajuće ostavlja više od 99% RNK meta bez strukturnih informacija. Stoga, Osnovni cilj naše studije je da razvijemo nove računarske metode sposobne da predvide modele strukture RNK visokog kvaliteta, popunjavajući ovu značajnu informaciju.
Profesor Zhang, viši glavni istraživač u CSI Singapuru i odgovarajući autor studije, rekao je: „Naš primarni cilj ove studije je da premostimo jaz između oskudice eksperimentalnih RNK struktura i sve veće potražnje u oblasti biologije RNK i industrije lekova. S tim u vezi, visokopouzdani DRfold modeli mogu se koristiti kao polazna tačka za vođenje dizajna RNK lekova i virtuelni skrining, ili da pomognu u razjašnjavanju bioloških funkcija molekula RNK u ćelijama.“
„Uzimajući u obzir moć i efikasnost mRNA vakcina u borbi protiv pandemija, alati kao što je DRfold igraju ključnu ulogu u predviđanju i optimizaciji RNK struktura i stabilnosti vakcina. Štaviše, ovi alati se mogu koristiti za proučavanje bioloških funkcija RNK, posebno onih koje nisu -kodiranje RNK i dizajniranje novih RNK eksperimenata koristeći predviđene modele koji prate paradigmu od sekvence do strukture do funkcije“, dodao je prof Zhang.
Grupa je otvorila izvorne kodove DRfold-a javnoj zajednici preko svoje veb stranice: https://zhanggroup.org/DRfold. Njegova visoka skalabilnost i okvir otvorenog koda čine ga neverovatno fleksibilnim i primenljivim za rešavanje drugih srodnih problema, kao što je modeliranje interakcije RNK-proteina.
Krećući se napred, tim predviđa proširenje svoje strategije AI kako bi obuhvatio interakcije proteina i RNK, oblast u kojoj trenutno nema pouzdanih pristupa AI za predviđanje kompleksne strukture proteina i RNK visokog kvaliteta. Takvi alati su veoma relevantni za označavanje funkcije RNK i otkrivanje RNK lekova.
Pored toga, tim se nada da će dodatno poboljšati DRfold-ovu tačnost u predviđanju strukture jednolančane RNK. Jedna od inherentnih barijera proizilazi iz ograničene dostupnosti eksperimentalnih RNK struktura, što utiče na tačnost modela dubokog učenja, posebno za RNK velike veličine (približno više od 200 nukleotida).
Potrebne su nove strategije i ideje da se probije usko grlo u predviđanjima strukture RNK visoke preciznosti, a istraživači trenutno rade na tome uz ohrabrujući napredak.