Istraživači predvođeni ESRF, evropskim sinhrotronom, otkrili su da amiloidni oligomeri igraju ulogu u ubrzavanju mitohondrijalne energije tokom ranih stadijuma Alchajmerove bolesti, za razliku od onoga što je ranije pronađeno u naprednijim Alchajmerovim moždanim tkivima.
Poreklo Alchajmerove bolesti, koja pogađa 30 miliona ljudi širom sveta, još uvek nije jasno uprkos međunarodnim istraživačkim naporima i značajnom napretku u istraživanju.
Pa ipak, identifikovanje faktora koji pokreću ovu neizlečivu neurodegenerativnu bolest je od suštinskog značaja za pronalaženje boljih načina da se dijagnostikuje Alchajmerova bolest, odloži njen početak i spreči napredovanje. „Pre nego što razumemo patologiju, moramo razumeti biologiju“, objašnjava Montse Soler Lopez, šef grupe za strukturnu biologiju u ESRF-u i ko-korespondentni autor studije.
Alchajmerova bolest je neizlečiva bolest koja se obično javlja posle 65. godine. Međutim, promene u mozgu počinju 20 godina pre nego što se bolest pojavi. „Smatramo da do poremećaja u funkcionisanju mitohondrija može doći 20 godina pre nego što osoba pokaže simptome bolesti“, objašnjava Soler Lopez. Dugo vremena, istraživači su se fokusirali na amiloidne plakove u mozgu kao potencijalni uzrok bolesti. Međutim, ova hipoteza se trenutno preispituje.
Tim Solera Lopeza, zajedno sa naučnicom Irinom Guče sa Instituta de Biologie Structurale (CNRS, CEA, Universite Grenoble Alpes) i istraživačima u EMBL, sprovodi novu liniju istraživanja koja se fokusira na faktore starenja, kao što je mitohondrijalna disfunkcija. Mitohondrije se često nazivaju „elektranom ćelija“ zbog njihove suštinske uloge u proizvodnji energije. Vremenom, mitohondrije trpe oksidativni stres, a to dovodi do njihovog kvara.
Nedavno otkriće ukazuje da osobe sa Alchajmerovom bolešću mogu pokazati akumulaciju amiloida unutar mitohondrija, dovodeći u pitanje prethodno uverenje da su amiloidi prisutni isključivo izvan neurona.
Tokom početnih faza Alchajmerove bolesti, amiloidi obično postoje u obliku amiloid-beta oligomera pre nego što se pretvore u fibrile. Soler Lopez i njen tim istražuju šta se dešava unutar mitohondrija tokom ovih ranih faza.
Energiju proizvode mitohondrije kroz respiratorni lanac, koji se sastoji od pet proteinskih kompleksa koji moraju da funkcionišu kooperativno i efikasno za proizvodnju energije. Među ovim kompleksima, kompleks I (CI) ima značajan značaj kao najveći i najkritičniji enzim u respiratornom lancu.
Da bi CI ispravno funkcionisao, faktori sklapanja su od suštinskog značaja, a kompleks faktora sklapanja poznat kao sklop mitohondrijalnog kompleksa I (MCIA), koji se sastoji od tri jezgra proteina — ECSIT, ACAD9 i NDUFAF1 — igra ključnu ulogu u koordinaciji sklapanja CI za optimalno funkcionalnost.
„Cilj nam je da razumemo interakcije između kompleksa I i kompleksa faktora sklapanja tokom početnih faza akumulacije amiloida, posebno kada se odvija u predsimptomatskim fazama bolesti“, objašnjava Lindzi Mekgregor, mlađi naučnik na ESRF-u i prvi autor rada.
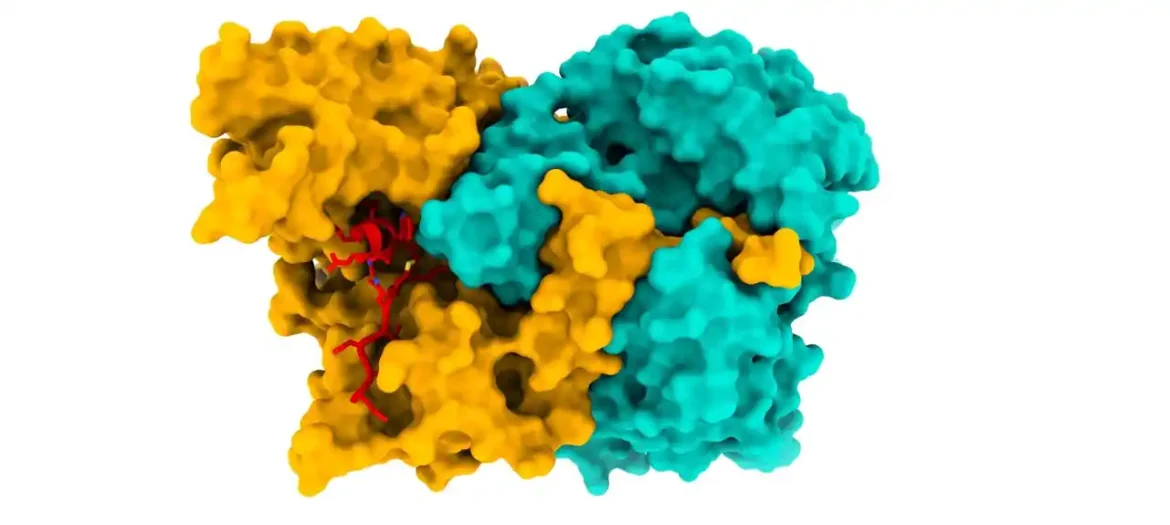
Naučnici su utvrdili strukturu kompleksa ACAD9-ECSIT pomoću krio-elektronske mikroskopije. „Ovo je proboj jer nam poznavanje strukture omogućava da sagledamo detaljan uvid u mehanizam sklapanja“, objašnjava Soler Lopez.
Soler Lopez i njene kolege su otkrile da ECSIT igra ulogu u deaktivaciji funkcije oksidacije masnih kiselina ACAD9 kroz proces deflavinacije, preusmeravajući protein na njegovu ulogu u sastavljanju CI. Ovo ima značaj za koordinaciju i regulisanje ćelijskih energetskih mehanizama.
Njihova zapažanja takođe pokazuju da je jedan preduslov za pravilno formiranje MCIA defosforilacija ECSIT-a specifična za mesto, pri čemu defosforilacija omogućava interakciju ACAD9-ECSIT.
Eksperimentalni rezultati su otkrili da u prečišćenim mitohondrijama, ECSIT defosforilacija postaje izraženija u prisustvu akumulacije amiloid-beta oligomera. Zauzvrat, ova akumulacija amiloida rezultira prekomerno aktivnim CI, u skladu sa povećanom stabilnošću defosforilisanog MCIA kompleksa koji pomaže pravilnom formiranju CI.
Ovi nalazi se razlikuju od prethodnih studija koje su uključivale moždana tkiva pacijenata sa Alchajmerovom bolešću, što je ukazivalo na gašenje CI. Soler Lopez objašnjava: „Uočavamo upravo suprotno, sugerišući da u ranim stadijumima bolesti, amiloid-beta oligomeri stimulišu prekomerno aktivni CI, stvarajući štetan ciklus koji na kraju dovodi do oštećenja respiratornog lanca.
I ona zaključuje: „Ovi nalazi nude uvid u ulogu amiloid-beta oligomera na početku bolesti, potencijalno otvarajući nove puteve za rešavanje Alchajmerove bolesti u ranim fazama.“