Zamislite život ćelije kvasca, kako lebdi po kuhinji u spori koja na kraju sleti na činiju grožđa. Život je dobar: hrana danima, bar dok neko ne primeti trule plodove i ne izbaci ih. Ali onda sunce sija kroz prozor, deo tezge na kojoj se nalazi činija se zagreva, i odjednom život postaje neprijatan za skromni kvasac. Kada temperature postanu previsoke, ćelije isključuju svoje normalne procese kako bi prebrodile stresne uslove i živele da se guštaju grožđem drugog, hladnijeg dana.
Ova „reakcija toplotnog šoka“ ćelija je klasičan model biološke adaptacije, deo fundamentalnih procesa života — sačuvanih u stvorenjima od jednoćelijskog kvasca do ljudi — koji omogućavaju našim ćelijama da se prilagode promenljivim uslovima u svom okruženju.
Godinama su se naučnici fokusirali na to kako različiti geni reaguju na toplotni stres da bi razumeli ovu tehniku preživljavanja. Sada, zahvaljujući inovativnoj upotrebi naprednih tehnika snimanja, istraživači sa Univerziteta u Čikagu dobijaju neviđeni pogled na unutrašnju mašineriju ćelija kako bi videli kako one reaguju na toplotni stres.
„Adaptacija je skrivena supermoć ćelija“, rekao je Asif Ali, doktor nauka, postdoktorski istraživač na Učikagu koji je specijalizovan za snimanje slika ćelijskih procesa. „Oni ne moraju stalno da koriste ovu supermoć, ali kada se jednom zaglave u teškom stanju, odjednom, nema izlaza. Dakle, koriste ovo kao strategiju preživljavanja.“
Ali radi u laboratoriji Dejvida Pinkusa, doktora nauka, docenta za molekularnu genetiku i ćelijsku biologiju na Učikagu, gde njihov tim proučava kako se ćelije prilagođavaju stresnim i složenim okruženjima, uključujući odgovor na toplotni šok.
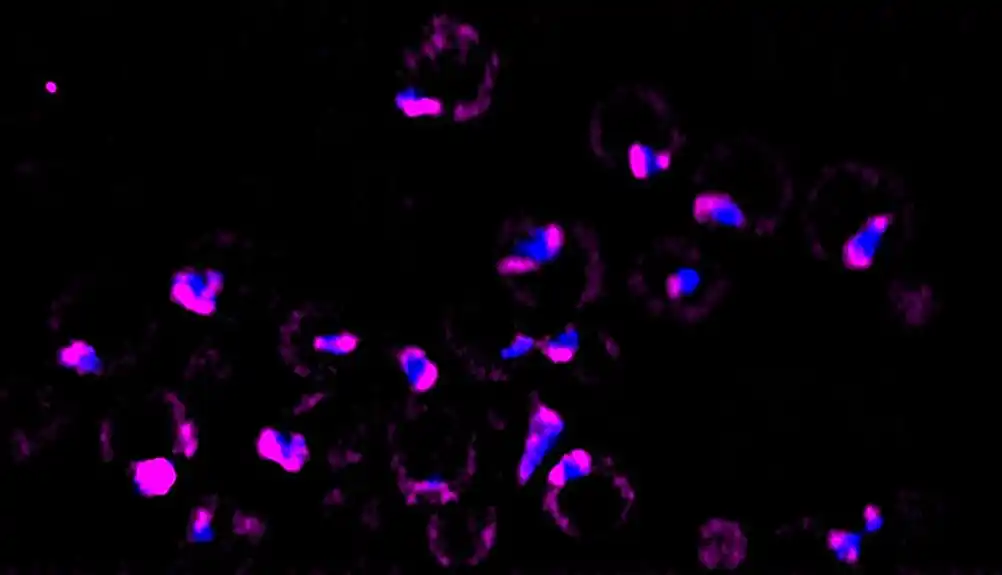
U novoj studiji, objavljenoj 16. oktobra 2023., u Nature Cell Biologi, oni su kombinovali nekoliko novih tehnika snimanja kako bi pokazali da kao odgovor na toplotni šok, ćelije koriste zaštitni mehanizam za svoje siroče ribozomske proteine – kritične proteine za rast koji su veoma ranjivi. do agregacije kada se normalna ćelijska obrada prekine — čuvajući ih u kondenzatu sličnim tečnosti.
Kada se toplotni šok smiri, ovi kondenzati se raspršuju uz pomoć molekularnih šaperonskih proteina, olakšavajući integraciju proteina bez roditelja u funkcionalne zrele ribozome koji mogu ponovo da počnu da izbacuju proteine. Ovaj brzi ponovni početak proizvodnje ribozoma omogućava ćeliji da nastavi tamo gde je stala bez trošenja energije.
Studija takođe pokazuje da se ćelije koje nisu u stanju da održe tečno stanje ovih kondenzata ne oporavljaju tako brzo, zaostaju za 10 generacija dok pokušavaju da reprodukuju izgubljene proteine.
„Asif je razvio potpuno novu ćelijsku biološku tehniku koja nam omogućava da vizualizujemo siroče ribosomske proteine u ćelijama u realnom vremenu, po prvi put“, rekao je Pinkus. „Kao i kod mnogih inovacija, bio je potreban tehnološki proboj koji nam je omogućio da vidimo potpuno novu biologiju koja nam je ranije bila nevidljiva, ali se uvek dešavala u ćelijama koje smo proučavali godinama.
Ribozomi su ključne mašine unutar citoplazme svih ćelija koje čitaju genetička uputstva na RNK glasniku i grade lance aminokiselina koji se savijaju u proteine. Proizvodnja ribozoma za obavljanje ovog procesa je energetski intenzivna, tako da je u uslovima stresa kao što je toplotni šok, to jedna od prvih stvari koje se ćelija gasi da bi sačuvala energiju.
Međutim, u bilo kom trenutku, 50% novosintetizovanih proteina unutar ćelije su ribozomalni proteini koji još uvek nisu u potpunosti prevedeni. U ćeliji se proizvodi do milion ribozomalnih proteina u minuti, tako da ako se proizvodnja ribozoma prekine, ovi milioni proteina mogu ostati da plutaju uokolo bez nadzora, skloni da se skupljaju zajedno ili da se nepravilno savijaju, što može uzrokovati probleme u nastavku.
Umesto da se fokusiraju na to kako se geni ponašaju tokom toplotnog šoka, Ali i Pinkus su hteli da pogledaju unutar mašinerije ćelija da vide šta se dešava sa ovim „sirotim“ ribosomskim proteinima. Za ovo, Ali se okrenuo novom mikroskopskom alatu koji se zove 4D slika sa rešetkastim svetlosnim listovima koji koristi višestruke listove laserske svetlosti za kreiranje punodimenzionalnih slika komponenti unutar živih ćelija.
Pošto je želeo da se fokusira na ono što se dešava samo sa siročadima tokom toplotnog šoka, Ali je takođe koristio klasičnu tehniku zvanu „označavanje impulsa“ sa modernim obrtom: specijalna boja pod nazivom „HaloTag“ da označi novosintetizovane siročad proteine.
Često kada naučnici žele da prate aktivnost proteina unutar ćelije, koriste oznaku zelenog fluorescentnog proteina (GFP) koja svetli svetlo zeleno pod mikroskopom. Ali pošto u ćeliji postoji toliko zrelih ribosomskih proteina, korišćenje GFP-a bi samo osvetlilo celu ćeliju. Umesto toga, pulsno obeležavanje sa HaloTag bojom omogućava istraživačima da osvetle samo novostvorene ribozome i ostave tamne zrele.
Koristeći ove kombinovane alate za snimanje, istraživači su videli da su proteini bez roditelja sakupljeni u tečne kapljice materijala u blizini nukleola (Pincus je koristio naučni izraz „labavo povezana biomolekularna gnjeva“). Ove mrlje su bile praćene molekularnim šaperonima, proteinima koji obično pomažu procesu proizvodnje ribozoma pomažući savijanju novih proteina. U ovom slučaju, činilo se da pratioci „mešaju“ sakupljene proteine, držeći ih u tečnom stanju i sprečavajući ih da se zgrudavaju.
Ovaj nalaz je intrigantan, rekao je Pincus, jer su mnoge ljudske bolesti poput raka i neurodegenerativnih poremećaja povezane sa pogrešno savijenim ili agregiranim nakupinama proteina. Jednom kada se proteini zapetljaju, i oni ostaju takvi, pa se čini da je ovaj mehanizam „mešanja“ još jedna adaptacija.
„Mislim da je vrlo uverljiva opšta definicija za ćelijsko zdravlje i bolest ako su stvari tečne i kreću se unaokolo, vi ste u zdravom stanju, kada stvari počnu da se začepljuju i formiraju ove agregate, to je patologija“, rekao je Pinkus. „Stvarno mislimo da otkrivamo fundamentalne mehanizme koji bi mogli biti klinički relevantni, ili barem, u mehaničkom srcu tolikih ljudskih bolesti.“
U budućnosti, Ali se nada da će primeniti još jednu tehniku snimanja koja se zove krio-elektronska tomografija, aplikacija koja koristi elektronski mikroskop dok se uzorci ćelija zamrzavaju da bi se snimile slike njihovih unutrašnjih komponenti na atomskom nivou rezolucije. Još jedna prednost ove tehnike je što omogućava istraživačima da snime 3D slike unutar same ćelije, za razliku od odvajanja i pripreme proteina za snimanje.
Koristeći ovaj novi alat, istraživači žele da zavire unutar proteinskih kondenzata da vide da li su oni organizovani na način koji im pomaže da se lako rasprše i nastave sa aktivnostima kada se toplotni šok spusti.
„Moram da verujem da nisu samo pomešani i pomešani“, rekao je Pinkus. „Ono što se nadamo da ćemo videti unutar onoga što izgleda kao neorganizovana pomešana supa, postojaće neka struktura i red koji će im pomoći da tako brzo počnu ponovo da rastu.“