Istraživači iz Veill Cornell Medicine su osvetlili jedan od važnih načina na koji ćelije reaguju na stres. Nalazi bi takođe mogli biti relevantni za Alchajmerovu bolest, ALS i druge bolesti kod kojih ovaj mehanizam može biti nenormalno aktivan.
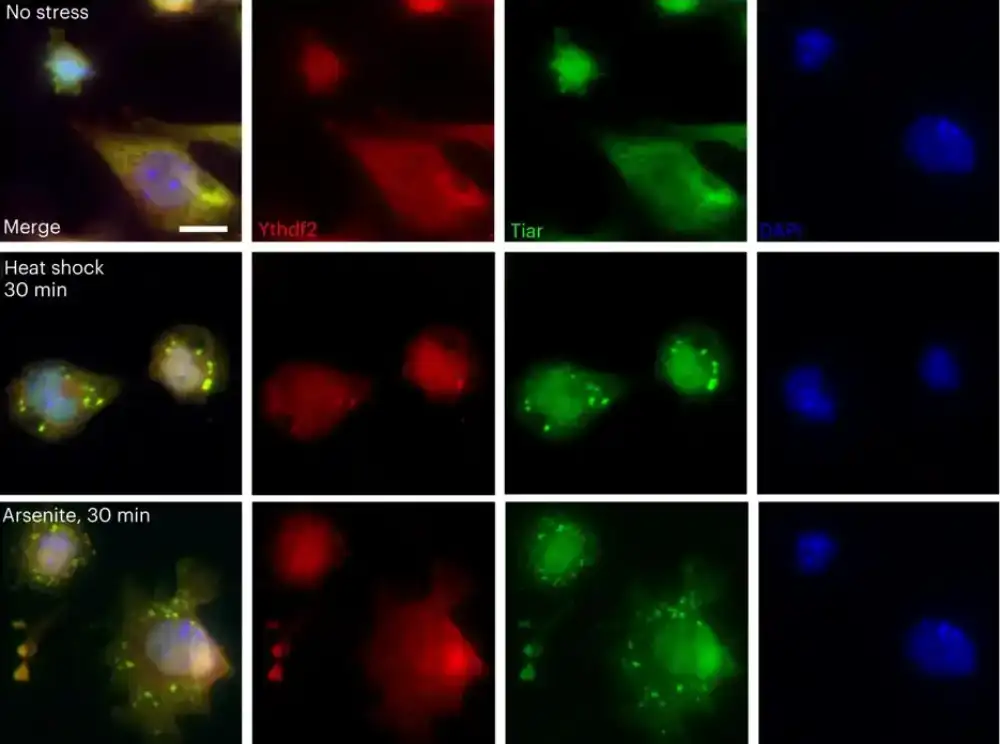
Kada su pod stresom toplotom, toksinima ili drugim potencijalno štetnim faktorima, ćelije skupljaju mnoge svoje RNK (mRNK), molekule koji nose uputstva za pravljenje proteina, u odeljke nalik kapljicama koje se nazivaju granule stresa. Ove granule sekvestriraju pogođene mRNK, sprečavajući njihovo prevođenje u proteine. Rezultirajuće usporavanje proizvodnje proteina pomaže ćeliji da sačuva energiju, da se rasprši i fokusira na popravke.
U studiji, koja se pojavila u Nature Structural & Molecular Biology, istraživači su potvrdili da je mala hemijska modifikacija na mRNK, poznata kao m 6 A, ključna za formiranje granula stresa.
„Uspeli smo da pokažemo da m 6 A ima primarnu ulogu u guranju mRNK u ove granule tokom ćelijskog stresa“, rekao je stariji autor studije dr Samie Jaffrei, Greenberg-Starr profesor farmakologije na Veill Cornell Medicine.
Prvi autor studije, dr Rajan Ris, bio je doktorant Veill Cornell Fakulteta medicinskih nauka tokom istraživanja.
Stresne granule sadrže mnogo različitih mRNK iz ćelije, ali ne i slučajni izbor. Dr Jaffrei i njegov tim su ranije pokazali da su mRNK koje se nalaze u granulama stresa često hemijski označene malim klasterom atoma koji se naziva metil grupa koja se vezuje za adenozin, jedan od gradivnih blokova iRNK. Dobijena mRNA ima regione koji su obogaćeni N6-metiladenozinom, ili m6A.
Takođe su otkrili da se regioni bogati m 6 A vezuju za ITHDF proteine — što više m 6 A ima mRNA, to je više ITHDF proteina. Potrebna je velika količina ITHDF proteina da bi se omogućilo da se kompleksi m 6 A-mRNA-ITHDF akumuliraju u granule stresa.
Dr Jaffrei i drugi su pretpostavili da m 6 A nije jedini faktor koji usmerava mRNK u granule stresa jer su duže mRNK takođe previše zastupljene. „Mislili smo da je dužina mRNK još jedan faktor, što je moguće jer duže mRNK imaju tendenciju da se zalepe za druge mRNK i formiraju agregate“, rekao je dr Džefri.
Međutim, u ovoj studiji, kada su istraživači konstruisali ćelije koje nisu mogle da formiraju m 6 A i izazvale formiranje granula stresa, otkrili su da duže mRNK više nisu previše zastupljene u granulama. Dr Jaffrei je zaključio da je m 6 A u dugim mRNK, a ne dužina mRNK sama po sebi, bio ključni faktor zbog kojeg su duže mRNK neproporcionalno bogate u granulama stresa.
Tokom proizvodnje proteina, mRNA se sastavljaju u jezgru ćelije iz manjih regiona RNK koji se nazivaju egzoni. Istraživači su primetili da se m 6 A dodaje mRNK čim se mRNK prave u jezgru.
Takođe su otkrili da eksoni koji su bili neobično dugi snažno pokreću formaciju m 6 A u odgovarajućoj iRNK. Ovi dugi egzoni imaju tendenciju da budu u dugim mRNK, što je objasnilo zašto dugačke mRNK imaju visoke nivoe m 6 A, i stoga je veća verovatnoća da će se pridružiti granulama stresa, u poređenju sa mRNK koje se sastoje samo od kratkih egzona.
Zašto je od koristi ćeliji da sekvestrira duže mRNK tokom epizoda ćelijskog stresa? Dr Jaffrei i njegove kolege spekulišu da je u dalekoj evolucionoj prošlosti veća verovatnoća da su duže mRNK bile nefunkcionalne ili čak od virusa. Razvoj ćelijskih puteva za usmeravanje m 6 A-mRNK u granule stresa možda je nastao kao način da se zaključaju ove sumnjive mRNK i spreče da prave nebezbedne proteine – iako se čini da je taj proces sada evoluirao u širu funkciju odgovora na stres.
Iako novo otkriće značajno unapređuje razumevanje osnovne biologije koja leži u osnovi m 6 A i formiranja granula stresa, ono takođe može biti relevantno za neurodegenerativne bolesti.
„Možda abnormalne granule stresa koje se formiraju u neurodegenerativnim bolestima kao što su Alchajmerova bolest i ALS pokreću te procese bolesti hroničnim hvatanjem korisnih m 6 A-sadržaja mRNK“, rekao je dr Džefri. „Nadamo se da ćemo saznati da li će blokiranje tog procesa hvatanja mRNA pomoći da se preokrene patologija u ovim neuronima.“