Do sada se smatralo da RNK i proteini interaguju samo nakratko tokom ćelijskih procesa. Istraživači sa Instituta Maks Plank za zemaljsku mikrobiologiju u Marburgu u Nemačkoj otkrili su da to nije slučaj. Tokom svog razvojnog ciklusa, bakterijski virusi „lepe“ specifične RNK za proteine domaćina. Kako autori opisuju u svojoj publikaciji u časopisu Nature, „RNAilacija“ bi mogla da otvori nove puteve za terapiju fagom ili razvoj lekova.
„Život je odnos između molekula“, napisao je poznati biolog Linus Pauling. Interakcije između proteina i RNK (ribonukleinske kiseline) utiču na translaciju, popravku genetskih informacija i transport ćelijskih gradivnih blokova. Ove interakcije su prolazni kontakti između RNK i RNK-vezujućih proteina na osnovu specifičnih RNK struktura ili sekvenci.
Sada je tim istraživača na Institutu Maks Plank u Marburgu u Nemačkoj otkrio da protein i RNK takođe mogu biti čvrsto vezani jedni za druge u takozvanoj kovalentnoj vezi.
U svojoj studiji, objavljenoj u aktuelnom broju časopisa Nature, istraživačka grupa koju vodi dr Katarina Hofer ispitala je sistem bakterija i bakterijskih virusa (bakteriofaga). Potonji napadaju vrlo specifične bakterije, kao što je T4 fag koji inficira bakteriju E. coli. T4 je „brzi ubica“: bakterijska ćelija se uništava 20 do 30 minuta nakon početka infekcije. Ovo je brže nego što antibiotik deluje. Sa rezistencijom na antibiotike u porastu, terapija fagom se istražuje kao potencijalna alternativa za lečenje bakterijskih infekcija.
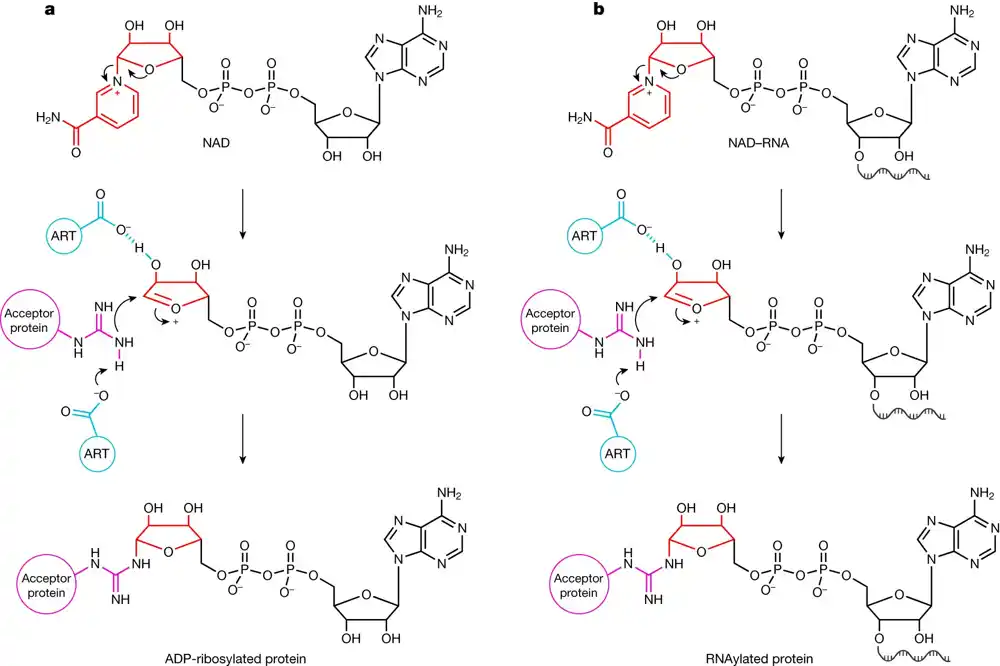
Da bi zarazio bakteriju, bakteriofag T4 je razvio fascinantne strategije. Nakon invazije, koristi tri različite ADP-riboziltransferaze (ART) kao biokatalizatore. Vezivanjem dela koenzima nikotinamid adenin dinukleotida (NAD) za proteine, ovi ART modifikuju više od 30 proteina domaćina. Ovo omogućava fagu da reprogramira i ubije bakteriju.
Katharina Hofer već neko vreme proučava funkciju RNK. Posebno je zainteresovana za NAD-RNA, koje su RNK koje nose NAD prilog. Pre osam godina, ona i njene kolege sa Univerziteta u Hajdelbergu otkrile su da se ova vrsta RNK javlja u bakterijama. Od tada, NAD-pokrivene RNK su pronađene u mnogo različitih oblika i veličina iu različitim grupama organizama, ali njihov biološki značaj je ostao nejasan.
Katharina Hofer se pitala da li ADP-riboziltransferaza poput one koju koristi T4 fag može da veže ne samo NAD već i NAD-RNA za proteine. Da bi odgovorili na ovo pitanje, istraživači su morali sami da razviju mnoge metode.
Ali onda je postalo jasno: ART ModB faga T4 prihvata ne samo NAD, već i NAD-RNA kao supstrat—i u epruveti i in vivo, u živom sistemu. Istraživači su ovu novu reakciju – vezivanje cele RNK za protein – nazvali RNAilacijom. To je potpuno novi koncept prirodne interakcije RNK-proteina.
Ali zašto T4 fag koristi RNAilaciju? Očigledno, ovaj proces je neophodan za efikasnu infekciju faga, jer mutanti T4 faga kojima nedostaje ModB ubijaju bakterije mnogo sporije.
Istraživačka grupa je uspela da pokaže da u živim ćelijama ModB specifično vezuje različite RNK za bakterijske proteine uključene u translaciju.
Maik Volfram-Šauerte, prvi autor studije, sugeriše: „RNAilacija može biti deo strategije faga. Vezanje bakterijske RNK za ribozome može zaustaviti translaciju bakterijskih proteina, što omogućava fagu da reguliše biosintezu sopstvenih proteina .“
Da bi istražila molekularne mehanizme RNAilacije, Katharina Hofer je započela saradnju sa istraživačima na Univerzitetu u Hajdelbergu i Maks Plank institutu za multidisciplinarne nauke u Getingenu.
Katharina Hofer objašnjava: „Naši rezultati ne samo da proširuju prethodnu sliku razvojnog ciklusa faga. Oni ukazuju na potpuno novu biološku ulogu NAD-modifikovane RNK, naime aktivaciju RNK za enzimski transfer u protein. Ovo takođe otvara novi putevi istraživanja“.
Na primer, RNAilacija bi mogla postati alat za sintetičku biologiju u budućnosti. Kao „molekularni lepak“, može se koristiti za formiranje specifičnih konjugata RNK-protein da bi se iskoristila svojstva proteina i nukleinskih kiselina u kombinaciji.
Ali, ima još mnogo pitanja bez odgovora. „Neke ART prihvataju NAD-RNA, druge ne – ovo postavlja pitanje tačnog mehanizma“, objašnjava Katarina Hofer. „Poteškoća je u tome što je modifikacija prilično velika i složena. U epruveti, RNAilaciju je relativno lako otkriti, ali in vivo, raznolikost ciljnih proteina i RNK čini je izazovnim za proučavanje. Da bismo razjasnili funkciju RNAilacije, mi smo potrebno je razviti nove metode za proučavanje naših specifičnih pitanja u živom sistemu.“