Bakterije crpe iz arsenala oružja za borbu protiv lekova namenjenih da ih ubiju. Među najrasprostranjenijim od ovih oružja su enzimi koji modifikuju ribozome. Ovi enzimi postaju sve češći, pojavljuju se širom sveta u kliničkim uzorcima u nizu bakterija otpornih na lekove.
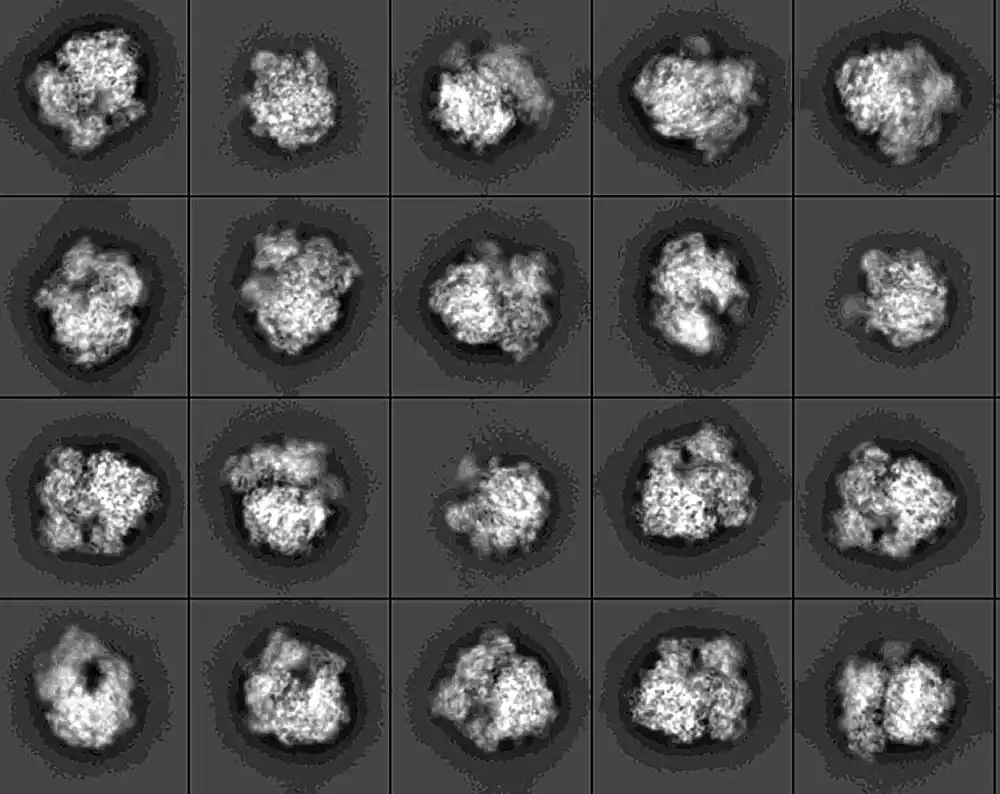
Sada su naučnici snimili prve slike jedne važne klase ovih enzima u akciji. Slike pokazuju kako se enzimi zakače za određeno mesto na bakterijskom ribozomu i stisnu ga poput pincete da bi izvukli RNK nukleotid i promenili ga. Istraživanje, koje su predvodili naučnici sa Univerziteta Emori, objavljeno je u Proceedings of the National Academi of Sciences (PNAS).
Napredna tehnika krioelektronske mikroskopije omogućila je trodimenzionalne snimke ultra visoke rezolucije.
„Videti je verovati“, kaže Kristin Danam, profesor hemije na Emoriju i kokorespondentni autor rada. „Onog trenutka kada vidite biološke strukture u interakciji u stvarnom životu na atomskom nivou, to je kao da rešavate slagalicu. Videćete kako se sve uklapa i dobijate jasniju predstavu o tome kako stvari funkcionišu.“
Uvidi mogu dovesti do dizajna novih antibiotskih terapija za inhibiranje aktivnosti enzima RNK metiltransferaze otpornosti na lekove. Ovi enzimi prenose mali ugljovodonik poznat kao metil grupa sa jednog molekula na drugi, proces poznat kao metilacija.
„Metilacija je jedna od najmanjih hemijskih modifikacija u biologiji“, kaže Grem Kon, profesor biohemije na Emorijevom medicinskom fakultetu i ko-korespondentni autor rada. „Ali ova mala modifikacija može fundamentalno da promeni biologiju. U ovom slučaju, daje otpornost koja omogućava bakterijama da izbegnu čitavu klasu antibiotika.“
I Conn i Dunham su takođe članovi Emori Antibiotic Resistance Center.
Prvi autor rada je Pooja Srinivas, koji je radio kao doktor nauka. kandidat na Emorijevom diplomskom programu iz molekularne i sistemske farmakologije. Od tada je diplomirala i sada je postdoktorant na Univerzitetu u Vašingtonu.
Danham je vodeći stručnjak za ribozom — složenu strukturu koja funkcioniše kao fabrika unutar ćelije za proizvodnju proteina. Proteini su mašine koje teraju ćelije da rade dok nukleinske kiseline kao što su DNK i RNK čuvaju nacrte za život. Ribozom je uglavnom napravljen od RNK, koja ne samo da čuva informacije, već može da deluje i kao enzim, katalizujući hemijske reakcije.
Jedan od ciljeva Dunhamove laboratorije je pronalaženje načina da se manipuliše bakterijskim ribozomima kako bi bili podložniji antimikrobnim sredstvima. Ako antimikrobno sredstvo uspešno inaktivira ribozome bakterija, to zaustavlja proizvodnju proteina neophodnih za rast i preživljavanje bakterija.
Ideja je da se iskoriste razlike u ljudskim ćelijskim ribozomima i ribozomima bakterija, tako da samo bakterije budu meta antimikrobnog leka.
Antimikrobni lekovi, međutim, moraju da prevaziđu odbranu bakterija.
„To je kao molekularna trka u naoružanju“, objašnjava Danham. Bakterije nastavljaju da razvijaju nova oružja kao odbranu od lekova, dok naučnici razvijaju nove strategije za razoružavanje bakterija.
Conn je vodeći stručnjak za oružje za odbranu od bakterija poznato kao enzimi ribozomalne RNK metiltransferaze. Ova porodica enzima prvobitno je otkrivena u bakterijama u zemljištu. Sada se sve više nalaze u bakterijskim infekcijama kod ljudi i životinja, što otežava lečenje ovih infekcija.
„Oni se sve češće pojavljuju u kliničkim uzorcima nekih gadnih bakterijskih patogena u različitim delovima sveta“, kaže Kon.
Enzimi mogu izazvati smrtonosnu otpornost na lekove kod patogena kao što su E. coli, Salmonella, Klebsiella pneumoniae, Pseudomonas aeruginosa i Enterobacteriaceae. Enzimi dodaju metil grupu na određenom mestu na bakterijskom ribozomu. Taj dodatak blokira sposobnost klase antibiotika poznatih kao aminoglikozidi da se vežu i izazovu njihovo antibakterijsko dejstvo.
Za PNAS rad, istraživači su se fokusirali na krivca u okviru ove porodice enzima poznatog kao ribosomalna RNK metiltransferaza C, ili RmtC.
Decenijama, istraživači su se oslanjali na tehniku poznatu kao rendgenska kristalografija da bi otkrili atomske detalje o tome kako molekularne mašine rade kada su molekuli raspoređeni u kristalu.
Na primer, 2015. godine, Dunhamova laboratorija je dobila precizne slike rendgenskom kristalografijom o tome kako enzim poznat kao HigB kida RNK da inhibira rast bakterija. Obuzdavanjem rasta bakterija koje ga stvaraju, HigB uspostavlja stanje mirovanja „perzisterske ćelije“ koje čini bakteriju tolerantnom na antibiotike.
Tajne o tome kako enzim RmtC interaguje sa ribozomom, međutim, izmiču rendgenskoj kristalografiji.
„RmtC je mnogo komplikovaniji“, objašnjava Dunham. „To je zanimljiv enzim iz perspektive osnovne nauke jer izgleda toliko drugačije od drugih.“
Nedavni napredak u krioelektronskoj mikroskopiji otvorio je vrata za zumiranje složenih mehanizama RmtC.
Krioelektronska mikroskopija ne zahteva kristalizaciju da bi se otkrile strukture molekula i njihova interakcija. Umesto toga, tečni uzorci se brzo zamrzavaju da bi se formirala staklena matrica. Staklasta matrica zadržava trodimenzionalnu strukturu molekula i štiti ih od propadanja intenzivnim elektronskim snopom.
Meisam Nosrati, bivši postdoktorski saradnik u laboratoriji Conn i koautor PNAS rada, pripremio je uzorke RmtC koji je u interakciji sa delom ribozoma E. coli. Iskoristio je stručnost koautora Lindzi Komstok, hemičara sa Univerziteta Vejk Forest koji je razvio tehniku za hvatanje i stabilizaciju enzima u potrebnom položaju.
Nosrati je zatim zamrznuo uzorke na sićušnoj mreži i poslao ih u pacifički severozapadni centar za Crio-EM na snimanje.
Kao diplomirani student u laboratoriji Dunham, Srinivas je zatim analizirao i interpretirao mikroskopski skup podataka. Koristila je kompjuterske algoritme da spoji hiljade pojedinačnih slika. Rezultat je pretvorio slike u flipbook koji je otkrio komplikovanu strukturu RmtC-a u akciji.
„Enzim se zakači kao klešta za ribozom“, objašnjava Danham. „Steže svoj stisak sve dok ne istisne nukleotid iz unutrašnjosti RNK heliksa. Zatim hemijski modifikuje taj nukleotid.“
Enzim je izuzetno specifičan u pogledu toga gde se vezuje za ribozom, ogroman makromolekul sastavljen od 50 različitih proteina i 6.000 različitih RNK nukleotida.
Istraživači su koristili biohemijske tehnike da bi potvrdili da ono što su primetili odgovara prethodnim nalazima o tome kako RmtC čini bakterije otpornim na aminoglikozidne antimikrobne lekove koji ciljaju ribozom.
Istraživači sada pokušavaju da razviju nove načine da se suprotstave efektima RmtC i srodnih enzima na osnovu novih informacija.
„Znanje o obliku enzima dok obavlja svoju hemijsku reakciju daje nam nove ciljeve za inhibiranje njegovih efekata“, kaže Conn. „Na primer, mogli bismo da ciljamo kleštavo delovanje enzima da pokušamo da ga sprečimo da se stisne i veže za ribozom. Sada znamo da enzim formira džep na svojoj površini gde bi mali molekul mogao da sedi da blokira ovu akciju.“