Izloženi smo jonizujućem zračenju češće nego što mislimo: kada se kupamo na suncu, koje emituje UV zrake, ili kada smo rendgenski. Čak i kada putujemo interkontinentalnim letom, koji dostiže 10.000 metara nadmorske visine. Ova vrsta zračenja je potencijalno štetna za DNK jer može da je ošteti, razbije njenu strukturu ili je modifikuje, što dovodi do stvaranja tumora.
Grupa naučnika predvođena Rafaelom Potestiom, uključujući Manuela Mikelonija, Lorenca Petrolija i Đanluku Latanci, istraživala je rupturu DNK na koju je uticalo jonizujuće zračenje. Izračunali su srednje vreme između izlaganja zračenju i rupture lanca DNK. I otkrili su da što je veća udaljenost između oštećenih delova DNK, to duže struktura DNK ostaje zajedno. Ovo, kao rezultat, daje ćeliji više vremena da popravi štetu. Rad je objavljen u časopisu Biophisical Journal.
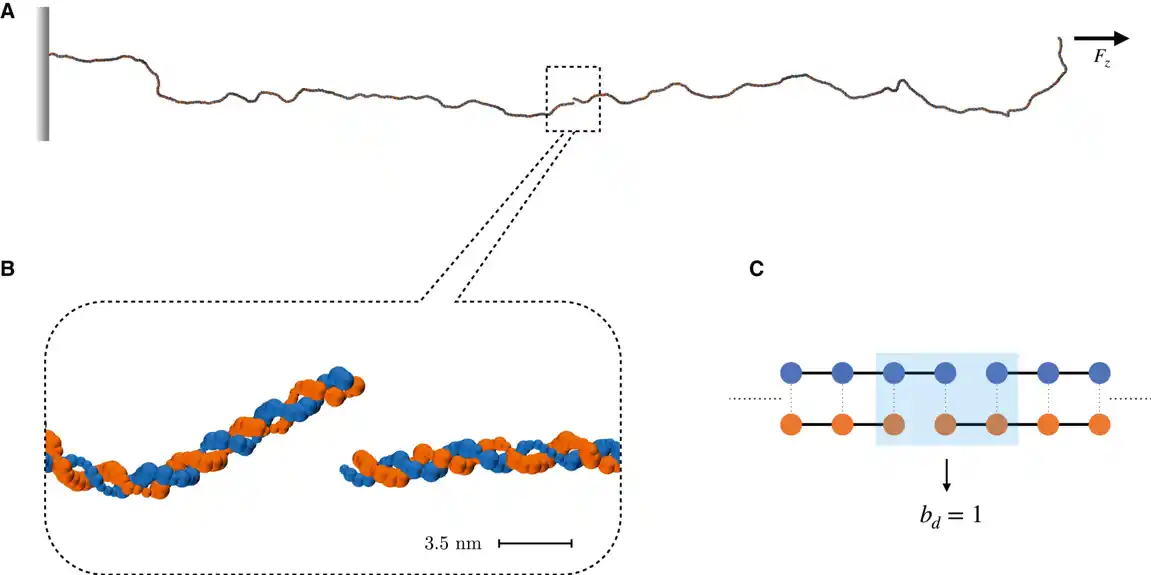
Istraživači su napravili kompjutersku simulaciju dvolančane DNK sekvence, kao u nekoj vrsti video igrice. Oni su imitirali oštećenja od zračenja na niti i posmatrali njeno ponašanje. Jedna od najopasnijih posledica uticaja radijacije na DNK je ruptura poznata kao prekid dvostrukog lanca (DSB), odnosno prekid strukturnog i hemijskog kontinuiteta DNK skeleta u dva komplementarna lanca.
Ova vrsta povrede može dovesti do ozbiljnih posledica na ćelijskom nivou. Naučnici su shvatili da se lanci ne kidaju odmah i da se vreme koje je potrebno da se lanac prekine eksponencijalno povećava sa rastojanjem između prekida u lancima DNK. Autori rada su uspeli da formulišu zakon za prosečno vreme kidanja na osnovu rastojanja između prekida pramenova. „Ove informacije su ključne – naglašava Raffaello Potestio – jer verovatno utiču na efikasnost procesa popravke DNK.
Ćelije imaju složen enzimski sistem za kontrolu i „održavanje“ DNK, koji se pokreće kada primi signale o povredi. Ovaj mehanizam se, međutim, ne pokreće odmah nakon oštećenja, a kašnjenje može uticati na normalno funkcionisanje ćelije. Modifikacija sekvence možda neće imati uticaja ako se dogodi preko jedne ili više sinonimnih mutacija, koje rezultiraju sintezom istog proteina.
Međutim, ako dođe do značajnih promena u DNK sekvenci ili grešaka u procesu popravke, u najboljem slučaju ćelija vrši samoubistvo (proces koji se naziva „apoptoza“), jer shvata da je sekvenca netačna ili nepopravljivo oštećena. U najgorem slučaju, s druge strane, ćelija obnavlja integritet lanca DNK, ali to može izazvati mutaciju, ili promenu sekvence nukleotida, što može dovesti do disfunkcionalnog ponašanja, a samim tim i do genetskih modifikacija, hromozomskih mutacija. ili početak raka.
Autori studije smatraju da je ovaj rad značajan za radiobiološki sektor i da predstavlja prvi korak ka mogućem razvoju u lečenju i prevenciji. Ova studija se izdvaja po upotrebi tehnika numeričke simulacije koje se mogu eksperimentalno reprodukovati: prenos simulacije sa računara u laboratoriju je jedan od ciljeva istraživača.
Razumevanje šta se dešava kada je DNK oštećena zračenjem otvara put, dugoročno, novim i sve preciznijim radioterapijskim tretmanima. „Ova studija ima dvostruku i komplementarnu svrhu – objašnjava Potestio.
S jedne strane, razumeti mehanizme koji uzrokuju ćelijsko oštećenje kako bi se sprečilo ili ograničilo takvo oštećenje, a sa druge, da se pronađe najbolji način da se izazove najveća moguća šteta. Ovo je važno, na primer, u oblasti protonske terapije, koja koristi jonizujuće zračenje, posebno protone, da cilja ćelije raka i ubije ih.“
„Radioterapija — nastavlja on — obuhvata niz složenijih pitanja kao što je, na primer, precizno lociranje zračenja deponovanog u tkivima raka, kako bi se sprečilo da zraci ciljaju zdrave ćelije koje bi mogle biti oštećene. Što više razumemo posledice zračenja i rupture DNK lanaca, to ćemo više biti spremni da razvijemo druge tretmane i ublažimo neželjene efekte“, zaključuje Potestio.