Mnoge bolesti se mogu uspešno lečiti u jednostavnom okruženju posude za ćelijsku kulturu, ali da bi uspešno lečio stvarne ljude, agens leka mora da prođe putovanje kroz beskonačno složenije okruženje u našim telima i stigne, netaknut, u zahvaćene ćelije. Ovaj proces, nazvan isporuka lekova, jedna je od najznačajnijih prepreka u medicini.
Saradnja između Nacionalne laboratorije Lavrence Berkeley (Berkeley Lab) i Genentech-a, člana Roche grupe, radi na probijanju nekih od uskih grla u isporuci lekova dizajniranjem najefikasnijih lipidnih nanočestica (LNP) – sitnih sferičnih kesica napravljenih od masnih molekula koji inkapsuliraju terapeutske agense dok se ne spoje sa ćelijskim membranama i otpuste njihov sadržaj. Prvi lek koji je koristio LNP odobren je 2018. godine, ali je metod isporuke postao globalni ugled sa Pfizer i Moderna mRNA COVID vakcinama.
„To je prilično pametan sistem, jer ako samo isporučite samu RNK ljudskom telu, RNK se razgrađuje nukleazama i ne može lako da pređe ćelijsku membranu zbog svoje veličine i naelektrisanja, ali LNP je bezbedno isporučuju u ćeliju, “ objasnio je ko-vodeći autor Chun-Van Ien, viši glavni naučnik u Genentechovoj grupi za male molekule farmaceutskih nauka.
LNP se sada široko istražuju kao sistem za isporuku vakcina za druge zarazne bolesti ili terapeutske vakcine za rak. Održivost ovih novih aplikacija zavisiće od toga koliko se dobro lipidne ovojnice spajaju sa ciljnim ćelijama, koliko su stabilne formulacije lek-LNP u skladištenju (tako da imaju dug vek trajanja) i koliko su stabilne u telu. (tako da mogu dati produženu aktivnost leka).
Sva ova svojstva kontrolišu mešavina molekula koja se koristi za stvaranje LNP-a i rezultujuća 3D struktura čestice. Tim pod Jenom i saradnicima koji vode Greg Hura i Michal Hammel, obojica biofizičari u laboratoriji Berkelei, već nekoliko godina proučavaju kako da podese strukturu LNP-a za željena svojstva.
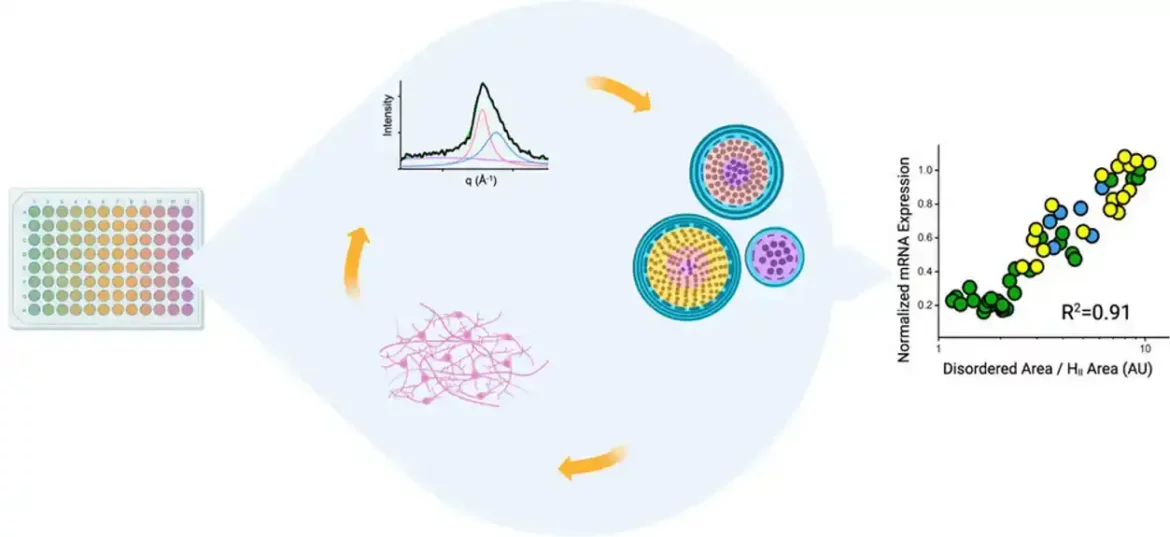
Njihov najnoviji rad, nedavno objavljen u ACS Nano, dokumentuje kako im radni tok velike propusnosti omogućava da proizvode i karakterišu LNP-ove rekordnom brzinom. Studija takođe uključuje prvu demonstraciju o tome kako struktura LNP-a korelira sa aktivnošću njegovog sadržaja, koji je za ovo istraživanje bio anti-sens oligonukleotid (ASO). ASO su mali isečci baznih parova RNK ili DNK koji blokiraju ekspresiju gena vezivanjem za lance iRNK i sprečavajući njihovo prevođenje u proteine. ASO su odličan način za lečenje bolesti uzrokovanih neispravnim proteinima ili prevelikom količinom proteina. Ali, kao i mRNA, one su podložne lutajućim nukleazama – enzimima koji razgrađuju RNK i DNK – a ćelije ih ne preuzimaju lako.
Naučnici su otkrili da su LNP-ovi koji nose ASO sa uredno uređenim, tesno upakovanim unutrašnjim strukturama doveli do boljeg utišavanja neispravnog gena u ljudskim neuronima koji je povezan sa degenerativnom bolešću, u poređenju sa LNP-ovima koji su imali neuređeniju strukturu. Nalazi su proizašli iz ćelijskih aktivnosti, a ne iz studija na životinjama, tako da predstoji još više posla, ali tim je uzbuđen što će graditi na ovim uvidima koristeći komplementarne alate svake institucije.
„Mi generišemo LNP-ove u visokoj propusnosti i Greg i Mihalov tim može da ponudi analizu visoke propusnosti“, rekao je Jen. „Ako pogledate o publikaciji danas, oni obično rade samo jednu ili dve formulacije, ali za nas je to drugačije. Možemo da generišemo velike skupove podataka, i mislim da je to razlog zašto možemo da imamo ovo veoma jedinstveno i cool otkriće.“
„Ovaj rad zaista postavlja metod koji ćemo primeniti na hiljade drugih formulacija koje nameravamo da okarakterišemo“, dodao je Hura, koji je deo oblasti bionauka u laboratoriji Berkli. „Nadamo se da će ovo biti opšti metod za ljude da optimizuju svoje lipidne nanočestice. Bilo da su to vakcine, i opet, vakcine su dobile najveću pažnju do sada, ili šire. Ova vrsta terapije ima veoma široku primenu izvan toga. .“
Na strukture LNP-ova utiče kako ih mešate, šta mešate i kojim redosledom. LNP imaju četiri sastojka — jonizujuće lipide, pomoćne fosfolipide, holesterol i polietilen glikol-lipide (PEG-lipidi) — i svaki sastojak ima različite oblike. Osim toga, mogu se kombinovati u različitim odnosima, što dovodi do eksponencijalnog broja mogućih formula. Što dodatno komplikuje stvari, LNP-ovi se vremenom menjaju. Formulacija koja počinje kao uredna, zbijena sfera će se na kraju pretvoriti u neuređeniju strukturu.
Naučnici iz Genentech-a razvili su tok rada vođen robotom koji može da generiše stotine LNP formulacija za samo nekoliko sati. Uzorci svake formulacije se zatim donose u laboratoriju Berkli da bi se izvršilo rasejanje rendgenskih zraka pod malim uglom (SAKSS) na naprednom izvoru svetlosti, kružnom akceleratoru čestica koji stvara snopove rendgenskih zraka različitih energija.
Biološki SAKSS snop može brzo da obradi mnoge uzorke, i za razliku od drugih oblika difrakcije rendgenskih zraka na biološkim materijalima, uzorci ne moraju biti zamrznuti ili kristalizovani — što bi moglo promeniti strukturu LNP-a i sprečiti naučnike da otkriju šta je LNP bi izgledali kao na fiziološkim temperaturama u ljudskom telu. SAKSS im takođe omogućava da snime snimke LNP-a u određenim vremenskim tačkama kako bi odredili njihovu strukturnu dugovečnost.
Pored toga, Genentech tim koristi ubrzani proces za proučavanje kako LNP utiču na ekspresiju gena u njihovim ciljnim ćelijama. Kombinovanjem svih ovih ubrzanih tehnika, cela saradnja je u stanju da pregleda potencijalne LNP-ove brzinom bez presedana.
Jen planira da nastavi da koristi SAKSS beamline za proučavanje malih detalja, kao što je kako promena koncentracije sastojka od 1% ili korišćenje nove mašine tokom proizvodnje može uticati na ćelijsku aktivnost LNP-a, kao i velika pitanja, kao što je da li se LNP ponašaju drugačije ako su noseći druge vrste tereta i kako oni stupaju u interakciju sa različitim ciljnim ćelijama.
„Znamo da mRNA LNP funkcionišu, ali još uvek postoji ogroman jaz u znanju“, rekao je Jen. „Zato se osećam kao da je naš list pionir u ovoj oblasti i nadamo se da ćemo takođe moći da generišemo više podataka i razumevanja za buduće aplikacije.“