Neuronska ceroidna lipofuscinoza je grupa razornih neurodegenerativnih poremećaja skladištenja lizozoma koji počinju u detinjstvu. Mutacije u CLN3 genu dovode do NCL-a zvane Battenova bolest, koju karakteriše progresivni gubitak vida, pokreta i spoznaje. Ciljane efikasne terapije nisu dostupne za ove poremećaje jer biološke uloge većine gena odgovornih za ove poremećaje nisu dobro definisane.
Istraživači na Medicinskom koledžu Bejlor i Dečjoj bolnici u Teksasu u SAD, Teleton institutu za genetiku i medicinu i Univerzitetu Federiko II u Italiji sada su otkrili da je CLN3 kritičan za biogenezu lizozoma i autofagičnu lizozomalnu reformaciju (ALR), otkrivajući novi mehanizam bolesti. kod Batenove bolesti.
Lizozomi deluju kao ćelijski digestori i kompaktori tako što razgrađuju širok spektar ćelijskih polimera i ostataka. Lizozomalna biogeneza je ključni proces potreban za de-novo („od nule“) generisanje lizozoma, dok je ALR završni korak autofagije, ćelijskog degradacionog procesa izazvanog gladovanjem ili drugim uslovima stresa.
Lizozomi se troše tokom početnih koraka autofagije i tokom vremena produženog gladovanja se generišu nazad preko ALR-a, procesa kojim se od zrelih lizozoma formiraju novi funkcionalni lizozomi. Ovde je tim otkrio da je CLN3 kritičan za generisanje novih lizozoma, narušavajući i de novo lizozomalnu biogenezu i ALR puteve, što rezultira akumulacijom „ostarelih“ lizozoma koji nisu u stanju da pravilno funkcionišu.
Studiju, objavljenu u Nature Communications, vodili su dr Andrea Balabio, profesor na Bailor koledžu i glavni istraživač na Institutu za neurološka istraživanja Jan i Dan Duncan (Duncan NRI), i dr Alessia Calcagni, docent na Bailor koledžu.
„S obzirom na to koliko je obnavljanje lizozoma i autofagija važno za opstanak i funkciju ćelija, ova studija ima potencijalno dalekosežne implikacije ne samo za Batenovu bolest već i za mnoga druga stanja koja su uzrokovana defektima u trgovini i skladištenju lizozoma“, rekao je dr Balabio. .
Nedostatak pouzdanog alata za proučavanje CLN3 bio je prepreka istraživačima koji su proučavali Batenovu bolest i tako je tim prvo stvorio novo CLN3 antitelo.
Na njihovo iznenađenje, otkrili su da CLN3 nije prisutan samo u lizozomima kao što se ranije mislilo, već da kada se prvi put sintetiše, prolazi kroz Golgijev kompleks gde dobija nekoliko modifikacija pre nego što stigne do svog konačnog odredišta, lizozoma.
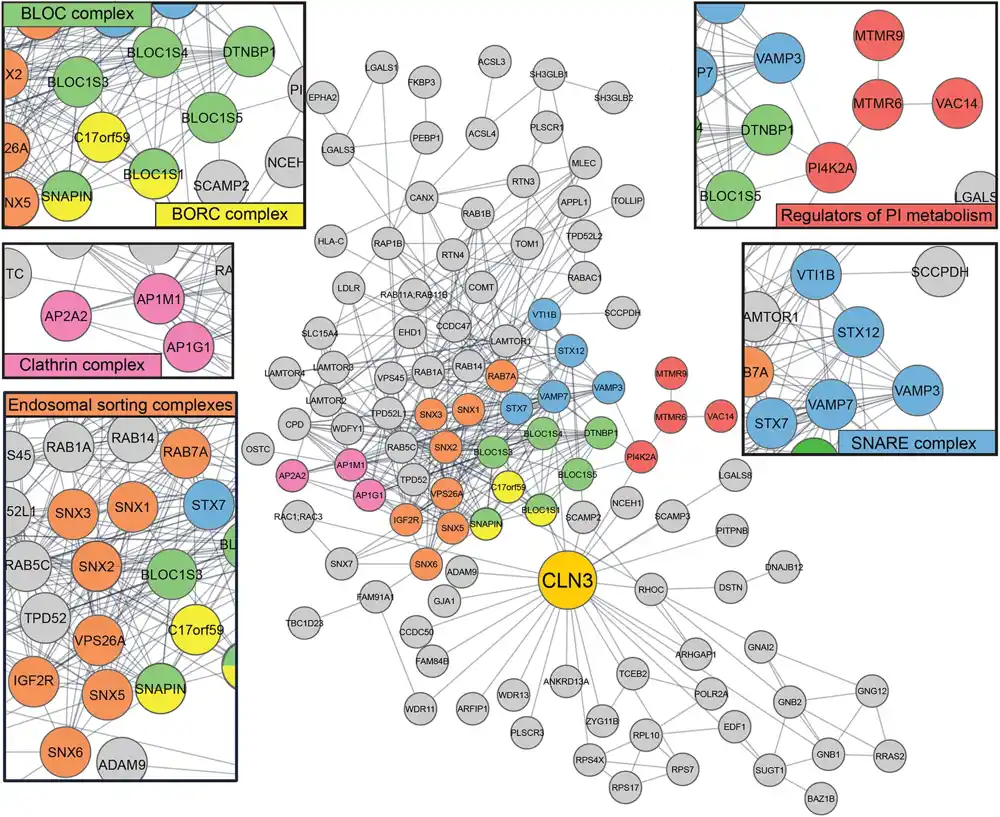
Zatim, da bi istražili biološku ulogu(e) CLN3, izvršili su analizu interaktoma kako bi identifikovali sve proteine koji se vezuju za CLN3. Ovi eksperimenti su otkrili da su nekoliko njegovih partnera proteini uključeni u intracelularne puteve trgovine i formiranje novih lizozoma, što sugeriše da on može igrati važnu ulogu u ovim procesima.
Utvrđeno je da je protein za lizozomsko sortiranje, receptor manoza-6-fosfata nezavisan od katjona (CI-M6PR) među najbogatijim interaktorima CLN3. Većina lizozomalnih enzima dobija ostatke manoza-6-fosfata kao „oznaku adrese“ koje zatim prepoznaju specifični receptori manoza-6-fosfata (analogno „osobi za isporuku“) da bi se usmerili u ispravne endo-lizozomalne odeljke („odredište“). „).
Zanimljivo je da su otkrili da gubitak CLN3 dovodi do pogrešnog sortiranja samog CI-M6PR do lizozoma gde je degradiran. Kao što se očekivalo, ovo je poremetilo lizozomalnu biogenezu. Novi lizozomi su pokazali globalno iscrpljivanje nekoliko degradativnih enzima. Pored toga, odsustvo CLN3 je dovelo do povećanja lizozoma i agregacije različitih intermedijara uključenih u autofagiju, što je karakteristika poremećene ALR i lizozomalne funkcije.
Lizozomski degradativni defekti uzrokovani pogrešnim sortiranjem CI-M6PR u ćelijama osiromašenim CLN3, ukinuli su i početnu potrošnju lizozoma i njihovu reformaciju tokom gladovanja, blokirajući ALR i time autofagiju.
Kada su istraživači prekomerno eksprimirali CLN3 u ćelijama bez CLN3 gena, to je dovelo do značajnog povećanja broja lizozoma, posebno tokom dužeg gladovanja, smanjene veličine lizozoma, povećanja nivoa lizozomalnih enzima i promovisanja formiranja lizozoma zavisno od autofagije. novi lizozomi. Nasuprot tome, utišavanje CI-M6PR potpuno je ukinulo CLN3 posredovanu tubulaciju i reformisanje lizozoma.
„Nadamo se da će saznanje kako tačno CLN3 utiče na funkciju lizozoma pomoći nama i drugima da identifikujemo efikasne terapije za Batenovu bolest u budućnosti“, rekla je dr Alesija Kalkanji. „Štaviše, ova studija ukazuje na oštećenje ALR-a i globalno smanjenje degradacionog kapaciteta lizozoma mogli biti mogući osnovni uzrok za druge NCL-ove i da će biti važno testirati u budućnosti.“