Imuni sistem štiti telo od napadača, kao što su bakterije, virusi ili tumori, svojom zamršenom mrežom proteina, ćelija i organa. Specijalizovane imune ćelije, nazvane citotoksične T ćelije, mogu se razviti u kratkotrajne efektorske ćelije koje ubijaju inficirane ili kancerogene ćelije u našim telima.
Mali deo tih efektorskih ćelija ostaje nakon infekcije i postaje dugovečne memorijske ćelije, koje „pamte“ infekcije i reaguju kada se infekcije ponovo pojave. Ali malo se zna o tome šta utiče na citotoksične T ćelije da se transformišu u ove efektorske i memorijske podtipove T ćelija.
Profesorka sa Instituta Salk Susan Kaech i vanredna profesorka Diana Hargreaves otkrile su da proteinski kompleks nazvan cBAF može otvoriti ili zatvoriti genetska „vrata“ za kontrolu sudbine T ćelija. Studija, objavljena u Immuniti, osvetljava kako se T ćelije bore i pamte infekcije i utire put za razvoj efikasnijih vakcina i lekova za lečenje raka.
„Pokazali smo kako se T ćelije transformišu u specijalizovane podtipove tokom infekcije i šta se dešava kada zabrljaju genetski plan. Bez ovog genetskog plana, T ćelije možda neće moći da razreše ili pamte infekcije, ili bi mogle da postanu kancerozne, npr. vidimo u T ćelijskom limfomu“, kaže Kaech, stariji i ko-korespondentni autor, direktor NOMIS centra za imunobiologiju i mikrobnu patogenezu i nosilac katedre NOMIS.
„Otkrivanje da je kompleks proteina cBAF neophodan u stvaranju različitih podtipova T ćelija otvara nova pitanja, kao što je da li možemo da kontrolišemo ovaj proces da bismo optimizovali funkciju imunih ćelija za terapiju raka?“
Na pitanje kako se citotoksične T ćelije razvijaju u efektorske i memorijske T ćelije može se odgovoriti posmatranjem kako se stvaraju – proces koji se oslanja na genetske instrukcije sadržane u hromatinu. Hromatin se sastoji od mešavine genetskog koda (DNK) koji funkcioniše kao uputstva, kao i proteina i RNK koji regulišu i štite ta uputstva.
Preuređivanje hromatina u ćeliji otkriva ili sakriva različite delove genetskog koda, zauzvrat menjajući dostupna uputstva. Kada su uputstva dostupna, proteini koji se nazivaju faktori transkripcije određuju da li se i koliko često čitaju.
Istraživači su znali da hromatin funkcioniše kao skela – štiti genetski kod unutar njega i štiti ga od faktora transkripcije. Da bi transkripcioni faktori pristupili tim uputstvima, verovatno im je potrebna pomoć cBAF-a koji remodeluje hromatin, koji može signalizirati proteine i RNK da otkriju genetski kod za faktore transkripcije.
„Remodeliranje hromatina je od suštinskog značaja za određivanje identiteta ćelija“, kaže prvi autor Brajan Mekdonald, diplomirani student u laboratoriji Kaech. „U drugim tipovima ćelija, poznato je da kompleks za remodeliranje hromatina cBAF igra glavnu ulogu u ćelijskoj diferencijaciji. Želeli smo da znamo da li je cBAF takođe važan za diferencijaciju citotoksičnih T ćelija.“
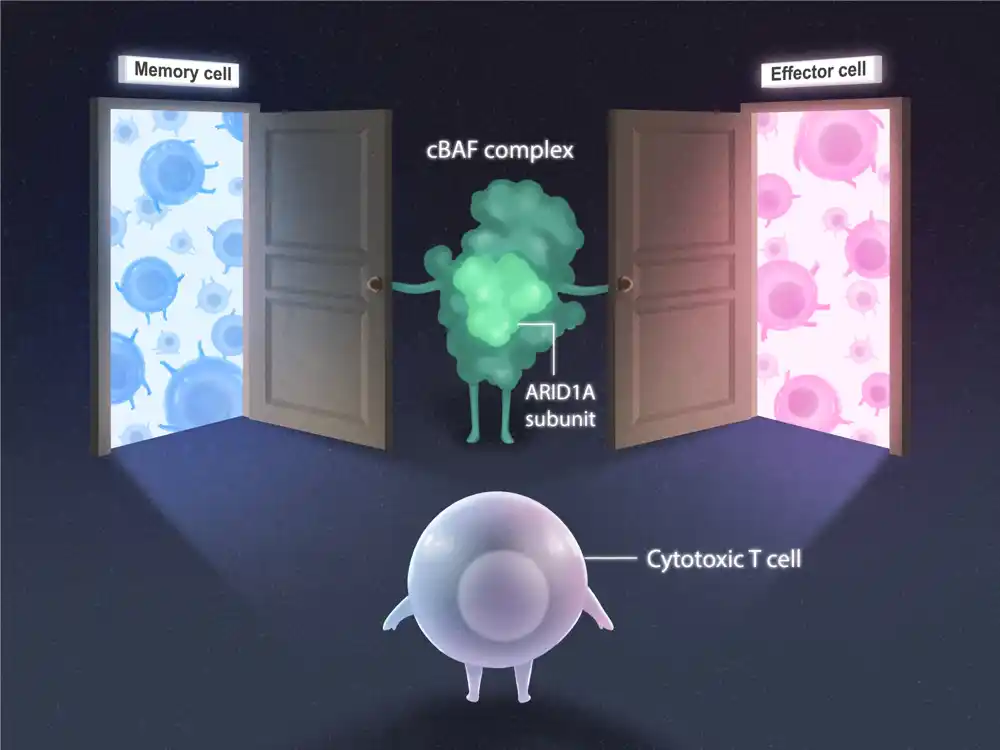
Kompleks cBAF se sastoji od mnogih podjedinica, uključujući ARID1A. Da bi istražio ulogu ARID1A u remodeliranju hromatina u T ćelijama, tim je ispitao T ćelije sa i bez ARID1A podjedinica kod miševa. Nakon jednonedeljne virusne infekcije (da bi se podstakao imuni odgovor T ćelija), istraživači su tražili promene u strukturi hromatina, lokaciji proteina i dostupnosti genetskog koda.
„Pejzaž hromatina je neizmerno evoluirao tokom infekcije“, kaže koautor Brent Čik, diplomirani student u laboratoriji Hargreaves. „Kompleksi cBAF koji nose podjedinicu ARID1A bili su ključni u preuređivanju hromatina kako bi faktori transkripcije mogli da pristupe genetskom kodu koji daje uputstva za razvoj različitih podtipova T ćelija sa specijalizovanim funkcijama.
Bez ARID1A, citotoksične T ćelije ne bi mogle da se pretvore u kratkotrajni efektorski podtip sa brzim odgovorom. Gubitak ARID1A nije sprečio citotoksične T ćelije da se pretvore u njihov dugovečni podtip memorije, ali memorijske ćelije napravljene bez ARID1A nisu bile toliko efikasne u reagovanju na virusnu reinfekciju. Konačno, formiranje memorijskih T ćelija koje se nalaze u organima, poput pluća ili tankog creva, zavisilo je od ARID1A. Bez ARID1A, memorijske T ćelije koje žive u tkivu uopšte ne bi mogle da se razviju.
ARID1A je bio ključni igrač, kao što je tim i sumnjao. A mehanizam je sada bio jasan – tokom infekcija, cBAF kompleksi sa ARID1A otvaraju različita hromatinska „vrata“ da bi otkrili genetski kod faktora transkripcije, koji zatim određuju sudbinu citotoksičnih T ćelija. Uspostavljanje ovog novog mehanizma otvara put za istraživanje o tome kako remodeliranje hromatina, genetski kod i faktori transkripcije zajedno doprinose uspešnom odgovoru imunog sistema.
„Naše istraživanje pokazuje da uklanjanje ARID1A iz jednačine imunog odgovora može u velikoj meri oštetiti našu sposobnost da se borimo protiv infekcije“, kaže Hargreaves, ko-korespondentni autor i nosilac razvojne stolice Richard Heiman i Anne Daigle. „Nadam se da naši nalazi inspirišu nova pitanja u istraživanju zaraznih bolesti i raka – i da smo pokazali vrednost zajedničkog postavljanja tih pitanja.“
Zatim, naučnici planiraju da ispitaju ovaj mehanizam koristeći ljudske T ćelije. Pored toga, oni imaju za cilj da razaznaju kako su memorijske T ćelije pogođene ovim procesom, pošto su one vredne prognostičke alatke za procenu humanih tumora.