Trenutno ne postoji tretman koji može zaustaviti tiho napredovanje multiple skleroze, a mnogi obećavajući lekovi su se pokazali neefikasnim u kliničkim ispitivanjima. Da bi smanjili ovu stopu neuspeha i bolje predvideli potencijal molekula kandidata, istraživači sa Pariskog instituta za mozak, kojima je koordinirao Bernard Zalc, razvili su novi model bolesti.
Model omogućava korelaciju degeneracije ili regeneracije mijelina sa evolucijom kognitivnih i motoričkih sposobnosti. Ovo postavlja bolje ciljanje molekula koji će verovatno promovisati remijelinizaciju i zaustaviti razvoj bolesti.
Kod multiple skleroze (MS), imuni sistem greškom napada mozak i kičmenu moždinu, uzrokujući potpuni gubitak mijelina. „Sintetisan od strane specijalizovanih ćelija, oligodendrocita, mijelin štiti nervna vlakna, garantuje dobro provođenje nervnih impulsa i obezbeđuje hranljive materije aksonima“, kaže Zalc.
„Ova zaštitna ovojnica obavija nervna vlakna i neophodna je za njihovo pravilno funkcionisanje. Njegov nestanak, nazvan demijelinizacija, izaziva senzorne i motoričke simptome: slabost donjih ili gornjih udova, gubitak ravnoteže, osetljivost i poremećaje vida.“
Tokom proteklih 30 godina, napravljen je značajan terapijski napredak u kontroli inflamatorne komponente multiple skleroze, čime se smanjuje šteta uzrokovana imunološkim sistemom tokom relapsa bolesti. Uprkos ovom napretku, i dalje postoji progresija invaliditeta kod pacijenata, iako se leče efikasnim imunoterapijama. Razlog? Neurodegeneracija. U suštini nezavisno od upale, opravdava potrebu za restorativnim tretmanima.
Međutim, popravljanje lezija mijelinske ovojnice – ili remijelinizacija – je pravi izazov. Klinički neuspesi su se tokom godina umnožili.
„Zašto nas molekuli kandidati sistematski razočaravaju kada se testiraju na ljudima? Jedno od mogućih objašnjenja: u pretkliničkoj fazi, oni se procenjuju na osnovu njihove sposobnosti da generišu nove ćelije koje proizvode mijelin. Ovaj kriterijum, zasnovan na posmatranju tkiva, nije dovoljan. Za da bi lek bio efikasan, on takođe mora da poboljša simptome bolesti ili čak potpuno obnovi senzorne i motoričke kapacitete, objašnjava istraživač. Ali trenutno je teško uspostaviti vezu između date demijelinizirajuće lezije i specifičnog senzomotornog deficita“, kaže Zalc.
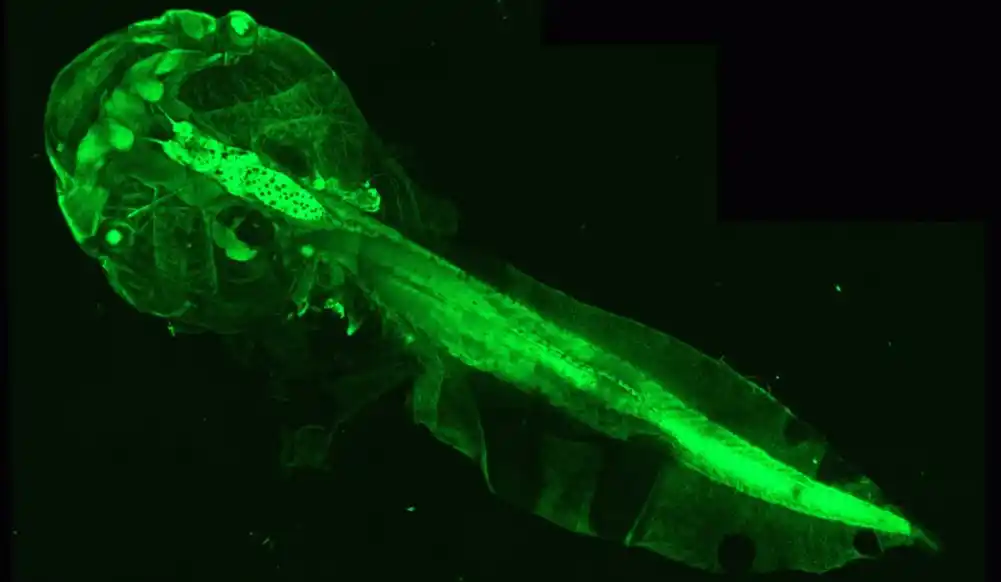
Da bi popunili ovu prazninu u razumevanju, istraživači iz Ketrin Lubecki i tima Bruna Stankofa sa Pariskog instituta za mozak su zamislili novi alat. Koristili su genetski modifikovane punoglavce Ksenopus, vodozemca sa savršeno providnim telom u ovoj fazi razvoja. Ova karakteristika olakšava prebrojavanje broja oligodendrocita koji proizvode mijelin unutar optičkog nerva, a zatim dovode ovaj indikator u korelaciju sa motoričkim i bihevioralnim sposobnostima životinje.
Pošto promene u broju oligodendrocita ukazuju na proces demijelinizacije ili remijelinizacije, tim je razvio proces za izazivanje ovih događaja na zahtev: istraživači su uveli supstancu pod nazivom metronidazol u akvarijum punoglavaca, koja je, pod uslovima u kojima je korišćena, izazvalo je gubitak oligodendrocita u optičkom nervu životinja. Ovaj gubitak je bio u korelaciji sa oštećenim vizuelnim sposobnostima — procenjenim virtuelnim testom izbegavanja mete.
Nakon izlaganja metronidazolu, istraživači su primetili spontanu popravku mijelina, mereno povećanjem broja oligodendrocita i poboljšanjem rezultata vizuelnih testova. Zatim su pokazali da se ovaj fenomen može ubrzati predstavljanjem punoglavaca sa molekulima koji promovišu remijelinizaciju.
„Naši rezultati pokazuju da su varijacije u motoričkim i senzornim performansama u savršenoj korelaciji sa nivoom demijelinizacije i remijelinacije tkiva. Ovaj model je stoga idealan za testiranje potencijala remijelinizacije novih lekova pre pokretanja dugih i skupih kliničkih ispitivanja“, kaže Zalc.
Postoji hitna potreba da se pronađu molekuli sposobni da deluju na demijelinizaciju, koja, u svom hroničnom obliku, dovodi do nepovratnog oštećenja aksona odgovornog za smrt neurona. Invalidnost tada neumitno napreduje.
„Ovaj novi alat, koji omogućava praćenje in vivo, ima potencijal da unapredi naše znanje o vezi između vizuelnih poremećaja – jednog od najčešćih simptoma multiple skleroze – i povezanih lezija demijelinacije“, zaključuje istraživač. „Ovo je prava odskočna daska za budući terapijski uspeh.“