Istraživači sa Univerziteta Kjušu otkrili su kako jedan mehanosenzitivni protein indukuje proces koji zgušnjava i ostavlja ožiljke na tkivu, poznat kao fibroza. Pokazalo se da protein, nazvan VGLL3, doprinosi fibrozi u više organa.
Tim se nada da će njihovi nalazi dovesti do novih tretmana protiv fibroze, patologije koja se pripisuje 45% svih smrtnih slučajeva u industrijskim zemljama. Njihova studija objavljena je u časopisu Nature Communications.
Kao odgovor na bilo kakvu povredu, telo odmah počinje niz događaja. Krv se zgrušava, tkivo počinje da se upali, a telo počinje da se leči. U nekim slučajevima to izlečenje dolazi u obliku plašenja i otvrdnjavanja. Kada je povreda na vašoj koži, ona se pojavljuje kao vidljiv ožiljak, ali šta se dešava kada su vitalni organi poput srca ili jetre oštećeni i očvrsnu? Ako se ne kontroliše, to može dovesti do gubitka mehanike i opasnih posledica.
Ove promene u tkivima se pripisuju ekstracelularnom matriksu. Ekstracelularni matriks je mreža proteina koja se nalazi u svakoj ćeliji u telu, i deluje kao žice na kolu koje omogućavaju ćelijama da komuniciraju jedna sa drugom, i snopovi u zgradi, dajući organima njihovu strukturu.
Previše ekstracelularnog matriksa čini ćeliju, a samim tim i organ, čvrstim i nefleksibilnim, stanje poznato kao fibroza. Jednostavno rečeno, fibroza je ukrućenje ćelija i tkiva. Njegove zdravstvene implikacije su duboke, jer može dovesti do lošeg pumpanja od strane srca ili ciroze jetre.
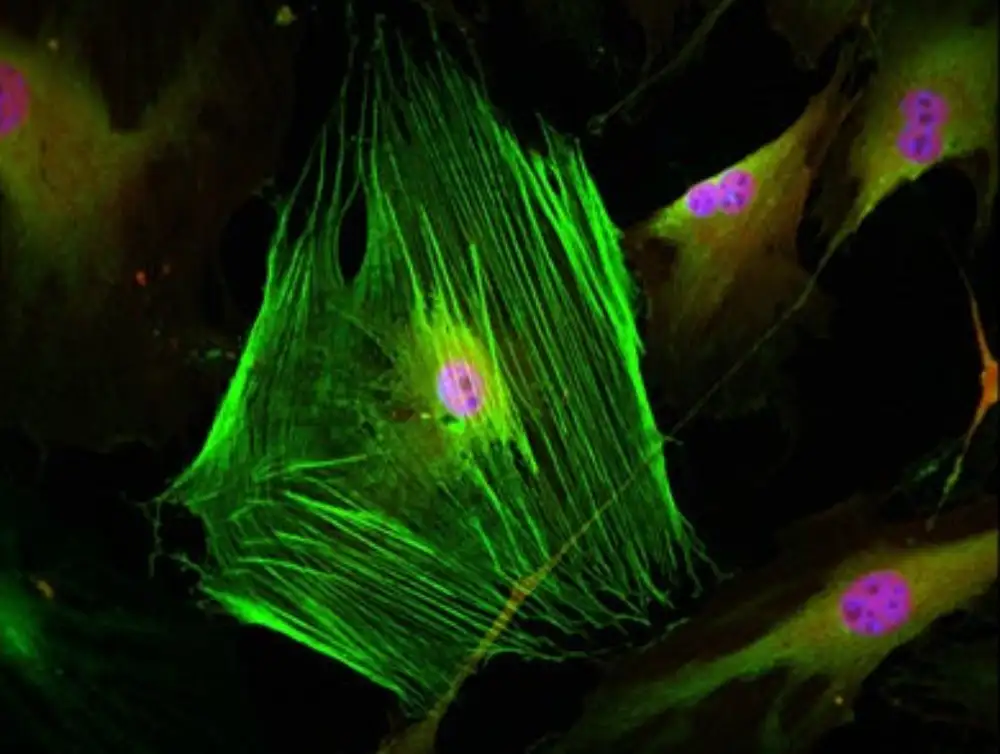
„Miofibroblasti su grupa ćelija koje proizvode kolagen, uobičajeni ekstracelularni matriks protein. U bolesnim organima se vidi da prekomerno proizvode kolagen. Jednom kada se miofibroblasti pojave u obolelim organima, fibroza se nastavlja na način snežne grudve“, kaže Mičio Nakaja vanredni profesor na fakultetu Univerziteta Kjušu. farmaceutskih nauka koji je vodio studiju. „Istovremeno, miofibroblasti su odgovorni za pravilno zarastanje rana.“
Da bi razumeli kako miofibroblasti postaju patološki, Nakaia i njegove kolege su pogledali kako različiti fizički stimulansi menjaju ekspresiju gena u ovim ćelijama. Pronašli su dosledne promene u ekspresiji jednog gena: VGLL3.
Njihova studija je pokazala da nakon srčanog udara, miofibroblasti u mišjem i ljudskom srcu izražavaju više VGLL3 proteina koji je doveo do proizvodnje kolagena. VGLL3 je takođe bio izraženiji u fibrotičnoj jetri miša, što sugeriše da doprinosi fibrozi u više organa. Nasuprot tome, sprečavanje aktivacije VGLL3 kod miševa dovelo je do daleko manje fibroze u ovim organima.
„Otkrili smo da se VGLL3 prenosi iz citoplazme u jezgro i počinje da proizvodi kolaž kao odgovor na mehaničke stimuluse. Kod miševa bez VGLL3, fibroza nakon srčanog udara je smanjena“, primetio je Nakaja.
Studija je dalje pokazala da odnos između krutosti matriksa i aktivacije VGLL3 postaje patološka pozitivna povratna sprega, u tome što čvršća matrica pokreće više aktivacije VGLL3, što pokreće ćeliju da proizvodi više kolagena.
Trenutno postoje samo tri leka za lečenje fibroze, i svaki ima svoja ograničenja. Uzimajući u obzir efekte VGLL3 na krutost ćelija, Nakaia veruje da istraživanje o tretmanima treba da posveti više pažnje ovom proteinu.
„U budućnosti očekujemo da ćemo razviti lekove i terapije za fibrozu ciljanjem na VGLL3“, zaključuje Nakaja.