Novi rad u Nature Communications osvetljava kako prethodno slabo shvaćen enzim funkcioniše u ćeliji. Mnoge bolesti su povezane sa hroničnim ćelijskim stresom, a Aaron T. Smith i kolege iz UMBC-a otkrili su da ovaj enzim igra važnu ulogu u ćelijskom odgovoru na stres. Bolje razumevanje kako ovaj enzim funkcioniše i kako se kontroliše moglo bi da dovede do otkrivanja novih terapijskih ciljeva za ove bolesti.
Enzim je nazvan ATE1 i pripada porodici enzima zvanih arginil-tRNA transferaze. Ovi enzimi dodaju arginin (aminokiselinu) proteinima, što često označava proteine za uništenje u ćeliji. Uništavanje proteina koji su pogrešno savijeni, često kao rezultat ćelijskog stresa, važno je da bi se sprečilo da ti proteini izazovu pustoš sa ćelijskom funkcijom. Akumulacija neispravnih proteina može izazvati ozbiljne probleme u telu, što dovodi do bolesti kao što su Alchajmerova bolest ili rak, tako da je mogućnost efikasnog uklanjanja ovih proteina ključ za dugoročno zdravlje.
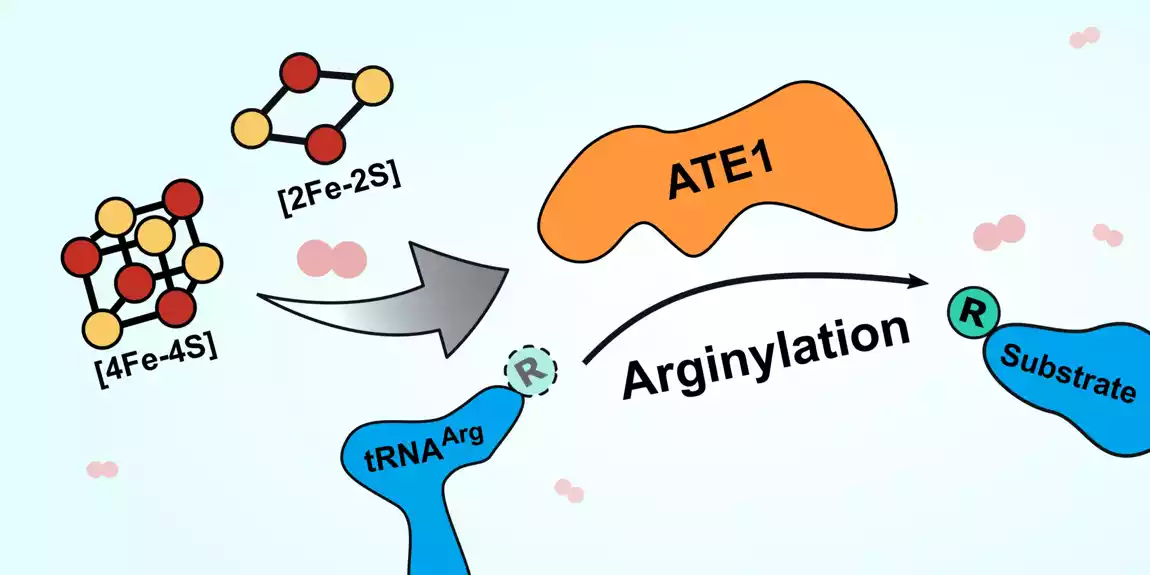
Novi rad pokazuje da se ATE1 vezuje za klastere gvožđa i sumpornih jona, i da se aktivnost enzima povećava dva do tri puta kada je vezan za jedan od ovih klastera gvožđe-sumpor. Štaviše, kada su istraživači blokirali sposobnost ćelija da proizvode klastere, aktivnost ATE1 se dramatično smanjila. Takođe su otkrili da je ATE1 veoma osetljiv na kiseonik, za šta veruju da se odnosi na njegovu ulogu u moderiranju stresnog odgovora ćelije kroz proces poznat kao oksidativni stres.
„Bili smo veoma uzbuđeni zbog toga, jer to ima mnogo veoma primamljivih implikacija nizvodno,“ posebno u vezi sa ulogom enzima u bolesti, kaže Smit, vanredni profesor hemije i biohemije.
Smithova laboratorija u početku radi sa proteinom kvasca, ali je takođe pokazala da se mišja verzija ATE1 ponaša slično. To je važno, objašnjava Smit. „Pošto se protein kvasca i protein miša ponašaju na isti način“, kaže on, „ima razloga da se veruje da pošto je ljudski protein prilično sličan proteinu miša, verovatno se i ponaša na isti način“.
Pre nego što su došli do svog revolucionarnog otkrića, Smit i tadašnji diplomirani student Verna Van, dr. ’22, biohemija i molekularna biologija, već duže vreme pokušavaju da indukuju ATE1 da se veže sa hemom, jedinjenjem koje sadrži gvožđe i neophodno je za vezivanje kiseonika u krvi, da bi se potvrdili rezultati druge grupe. Nije funkcionisalo, a oni su postajali frustrirani, priznaje Smit. Ali jednog dana, dok je Smit pripremao predavanje o proteinima koji se vezuju za klastere atoma metala i sumpora, shvatio je da proteini koje će pokriti sa svojim studentima liče na ATE1.
Nakon te spoznaje, Smit i Van su zauzeli novi pristup. U laboratoriji su dodali sirovine za stvaranje klastera gvožđe-sumpor u rastvor sa ATE1, a rezultati su pokazali da ATE1 zaista vezuje klastere. „Ovo izgleda obećavajuće“, seća se Smit razmišljanja. „Bili smo super uzbuđeni zbog toga.“
Činjenica da enzim uopšte vezuje klastere bila je zanimljiva i nova, „ali smo onda takođe pitali da li to utiče na sposobnost enzima da radi ono što radi“, kaže Smit. Odgovor, nakon više od godinu dana dodatnih eksperimenata, bio je odlučno da. U tom procesu, Smithova grupa je takođe utvrdila strukturu ATE1 u kvascu (bez klastera vezanog za njega), što je objavila u Journal of Molecular Biologi u novembru 2022.
Otprilike u isto vreme, druga grupa je takođe objavila nešto drugačiju ATE1 strukturu. Struktura druge grupe imala je jon cinka (drugi metal) vezan umesto klastera gvožđe-sumpor. Sa cinkom na mestu, jedna ključna amino kiselina se rotira za oko 60 stepeni. Možda izgleda nebitno, ali Smit veruje da je rotacija, za koju pretpostavlja da je slična sa klasterom, ključ za ulogu klastera u funkciji ATE1.
Rotirana aminokiselina je direktno u blizini mesta gde bi protein interagovao sa ATE1 da bi se modifikovao, na kraju ga označavajući za degradaciju. Promena ugla te aminokiseline menja oblik lokacije za koju bi se protein vezao „veoma suptilno“, ali menja svoju aktivnost „više nego suptilno“, kaže Smit.
Smit bi takođe želeo da istraži kako drugi metali, osim cinka i klastera gvožđe-sumpor, mogu uticati na aktivnost enzima. Pored toga, njegova laboratorija radi na utvrđivanju strukture ATE1 u organizmu koji nije kvasac i da potvrdi strukturu ATE1 sa vezanim klasterom gvožđa i sumpora.
Svi ovi koraci će izgraditi jasniju sliku o tome kako ATE1 funkcioniše i kako je regulisan u ćeliji. Smit takođe kaže da veruje da se proteini za koje do sada nije pokazalo da vezuju klastere gvožđe-sumpor zaista mogu da se oslanjaju na njih.
Ovaj novi rad zapravo podseća na Smithove prve dane u UMBC. Oduvek su ga zanimale modifikacije proteina, a dodavanje arginina je neobičnije. „To je uvek nešto što sam vratio u svoje misli i pomislio: ‘Oh, bilo bi zaista zanimljivo bolje razumeti kako to funkcioniše’, kaže on.
Nekoliko godina kasnije, njegova grupa je sada na čelu otkrivanja kako modifikacije arginina utiču na ćelijsku funkciju i bolest.