Rak je složena bolest i iako su milijarde dolara potrošene na pronalaženje sigurnih i efikasnih terapijskih sredstava za njega, još uvek postoji prostor za značajan razvoj. Istraživači su ciljali različite biološke entitete i procese za lečenje raka. Jedan primer su metabolički procesi koji reprogramiraju makrofage povezane sa tumorom (TAM), imune ćelije koje igraju ključnu ulogu u razvoju i napredovanju raka.
U normalnim okolnostima, makrofagi — bela krvna zrnca koja gutaju i ubijaju mikroorganizme, eliminišu mrtve ćelije i stimulišu imuni sistem — štite telo od bolesti. Međutim, TAM-ovi rade nešto značajno čudno: učestvuju u formiranju tumorskog mikrookruženja (TME), čime nanose štetu telu. U zavisnosti od stimulusa iz okoline i metaboličkih procesa, makrofagi se diferenciraju u dve klase: antitumorski M1 slični i protumorski M2 slični makrofagi. Potonji liče na TAM-ove. Dok makrofagi slični M1 inhibiraju rast tumora, makrofagi slični M2 rade upravo suprotno i tako igraju ključnu ulogu u proliferaciji ćelija raka.
Istraživači iz Kine su nedavno sproveli istraživanje literature, koje je objavljeno u Kineskom medicinskom žurnalu 20. oktobra 2022., kako bi bolje razumeli kako se to dešava. Kaže prof. Ji Zhang, odgovarajući autor članka, i profesor i direktor Centra za bioterapiju i Centra za rak u Prvoj pridruženoj bolnici Univerziteta Džengdžou, „TAM-ovi polarizovani u perifernoj krvi i rezidentni u tkivima predstavljaju ogroman segment infiltrirajućih mijeloidnih ćelija u TME većine malignih solidnih tumora. Važno je da TAM pokazuju proangiogena svojstva. U ovom pregledu razjašnjavamo metaboličko reprogramiranje TAM-a i istražujemo kako oni održavaju imunosupresiju kako bi pružili perspektivu za potencijalne metaboličke terapije.“
Metabolizam tumorskih ćelija—definisan kao skup biohemijskih procesa koji se dešavaju da bi se obezbedio opstanak organizama—igra ključnu ulogu u proliferaciji ćelija raka. Ćelije raka otimaju fiziološke sisteme tela kroz metaboličko reprogramiranje TME. Takvo reprogramiranje doprinosi tumorigenezi kroz aktivaciju bioloških procesa koji podržavaju opstanak, proliferaciju i rast ćelija.
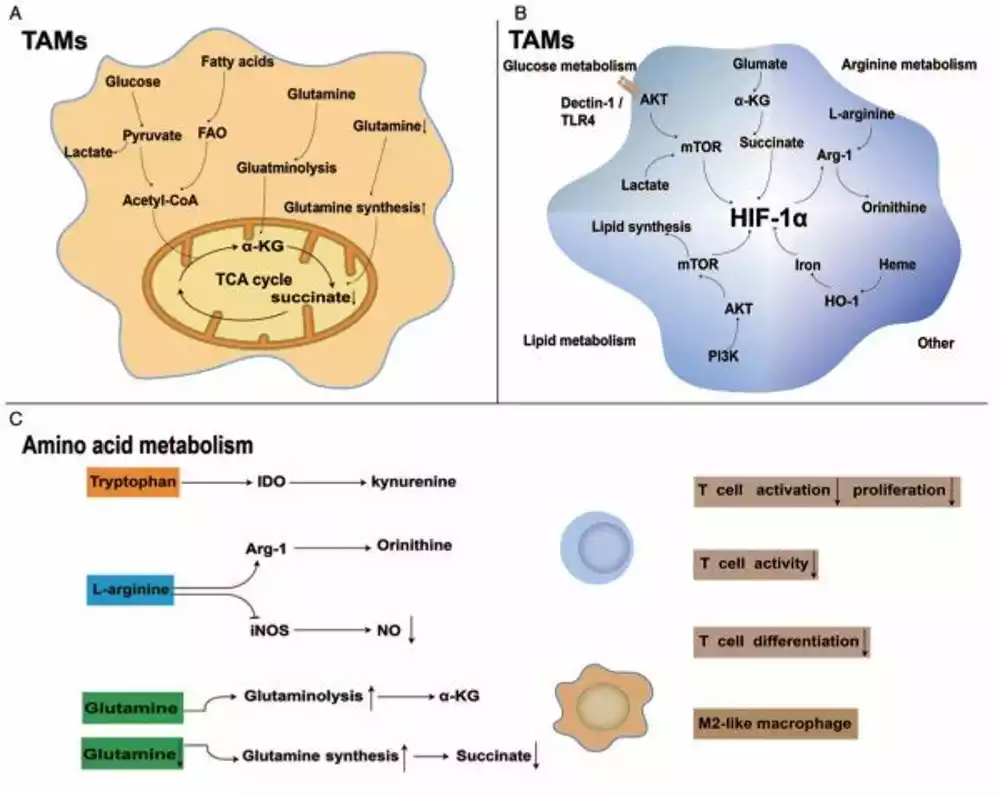
Zbog remodeliranja TME, TAM-ovi su u stanju da modulišu ključne metaboličke puteve koji uključuju metabolizam glukoze, lipida i aminokiselina i izazivaju imunosupresivni TME, štiteći tako ćelije raka od budnog imunološkog sistema i omogućavajući njihov nekontrolisani rast. Zbog gore navedenih razloga, ciljanje na puteve TAM-a koji su povezani sa metabolizmom može imati antitumorske efekte. Stoga je važno proučavati metaboličke ciljeve vezane za TAM u TME.
„TAM-ovi izražavaju pro-tumorski fenotip povećanjem glikolize, oksidacije masnih kiselina, efluksa holesterola i metabolizma arginina, triptofana, glutamata i glutamina. Prethodne studije o metabolizmu TAM-a pokazale su da metaboličko reprogramiranje ima intimnu međusobnu vezu sa antitumorskim -fenotipove tumora i ključno je za funkciju samih TAM-a. Ciljanje na puteve vezane za metabolizam se pojavljuje kao obećavajući terapeutski modalitet zbog masivnog metaboličkog remodeliranja koje se dešava u malignim ćelijama i TAM-ovima“, kaže dr Džang.
TAM manipulišu metaboličkim putevima na mnogo različitih načina. Na primer, otkriveno je da se enzimi koji promovišu metabolizam glukoze prekomerno proizvode u TAM izolovanim od pacijenata sa rakom pankreasa. Takođe je poznato da TAM menjaju metabolizam gvožđa. Pošto tumorske ćelije zahtevaju višak gvožđa, TAM-ovi — ključni izvori gvožđa — ga otpuštaju u TME, čime se povećava njegova dostupnost tumorskim ćelijama.
Međutim, ovim procesima se može manipulisati. Pokazalo se da je ciljanje puteva povezanih sa metabolizmom efikasno u suzbijanju tumora kod miševa, pa čak i u kliničkim ispitivanjima. Uključivanje terapeutika kao što su inhibitori imunološke kontrolne tačke (ICI) dodatno povećava efikasnost ciljanih metaboličkih terapija. ICI su lekovi koji blokiraju proteine koji se nazivaju „kontrolne tačke“. Ove proteine sintetišu imune ćelije, kao i ćelije raka (koje imitiraju ćelije našeg tela i na taj način izbegavaju da budu otkrivene i uništene od strane našeg sopstvenog budnog imunološkog sistema). Klinički dokazi jasno sugerišu da je efikasnost ICI poboljšana kada se u plan lečenja uključe terapijske strategije koje ciljaju na puteve vezane za metabolizam.
Dalja istraživanja o metaboličkom reprogramiranju, TAM-ovima i TME-u bi dovela do novih metoda za lečenje raka zasnovanih na imunoterapiji.